الرابطة التساهمية
Covalent Bond
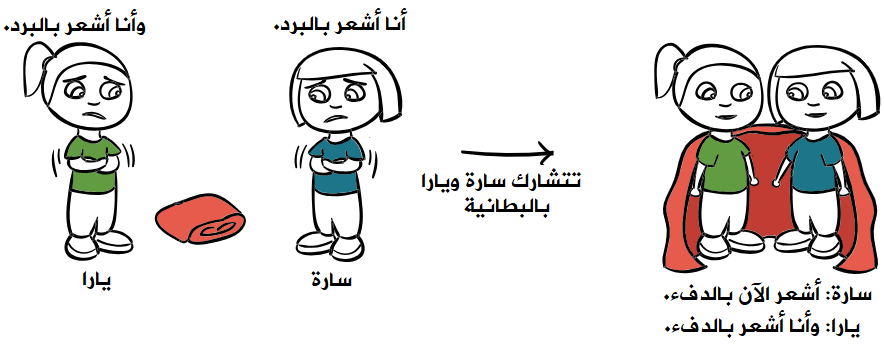
تنشأ الرابطة التساهمية بين ذرتين (لافلزين) تميلان لكسب الإلكترونات، فتتشارك الذرتان بزوج أو بزوجين أو بثلاثة أزواج من الإلكترونات للوصول إلى تركيب إلكتروني مشابه للغاز النبيل القريب منهما.
مفهوم الرابطة التساهمية
الرابطة التساهمية: الرابطة الكيميائية الناتجة من مشاركة ذرتين أو أكثر من العناصر اللافلزية لزوج أو أكثر من الإلكترونات.
أنواع الروابط التساهمية
الرابطة التساهمية على ثلاثة أنواع هي :
- رابطة تساهمية أحادية: وتنشأ عندما تتشارك ذرتان بزوج من الإلكترونات.
- رابطة تساهمية ثنائية: وتنشأ عندما تتشارك ذرتان بزوجين من الإلكترونات.
- رابطة تساهمية ثلاثية: وتنشأ عندما تتشارك ذرتان بثلاثة أزواج من الإلكترونات.
الرابطة التساهمية الأحادية Single Bond
تنشأ الرابطة التساهمية الأحادية بين ذرتين عندما تتشاركان بزوجٍ من الإلكترونات، وذلك بأن تقدم إحدى الذرتين إلكترون، وتقدم الأخرى إلكترون.
مثال:
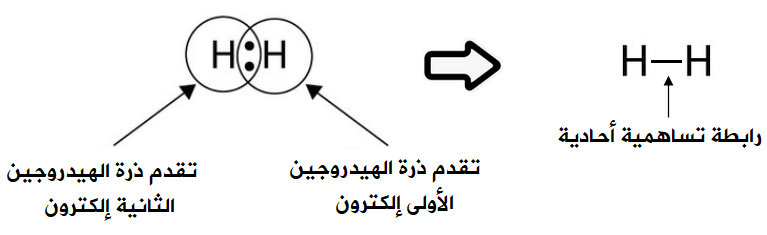
الرابطة في جزيء الهيدروجين H2 .
تحتوي ذرة الهيدروجين على إلكترون واحد في الغلاف الأخير.
1H : 1s1
انظر إلى تركيب لويس لذرة الهيدروجين:

ولكي تصل ذرة الهيدروجين إلى حالة الاستقرار، فإنها بحاجة إلى إلكترون، فتتشارك ذرة الهيدروجين الأولى بإلكترون مع ذرة الهيدروجين الثانية فتتكون رابطة تساهمية أحادية.
سؤال:
مثّل تكوين جزيء الفلور F2 بمعادلة كيميائية، وبين المواد المتفاعلة، والناتجة باستخدام رموز لويس.
علماً بأن العدد الذري للفلور = 9 .
الإجابة:
تحتوي ذرة الفلور على (7) إلكترونات في الغلاف الأخير.
9F : 1s2 2s2 2p5
ولكي تصل ذرة الفلور إلى حالة الاستقرار، فإنها بحاجة إلى إلكترون، فتتشارك ذرة الفلور الأولى بإلكترون مع ذرة الفلور الثانية فتتكون رابطة تساهمية أحادية.
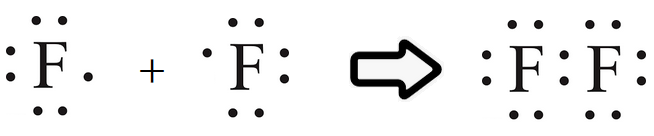
سؤال:
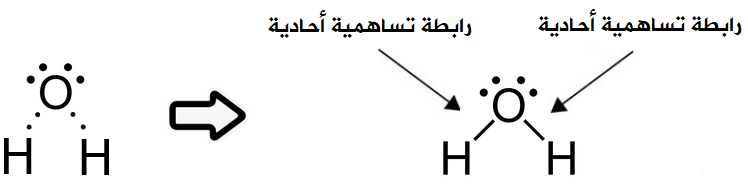
مثّل جزيء الماء H2O باستخدام تركيب لويس، وبين نوع الرابطة بين ذراته.
علماً بأن العدد الذري للهيدروجين = 1 ، والأكسجين = 8
الإجابة:
8O : 1s2 2s2 2p4
1H : 1s1
تحتاج ذرة الأكسجين إلى إلكترونين للوصول إلى حالة الاستقرار، وتحتاج كل ذرة هيدروجين إلى إلكترون للوصول إلى حالة الاستقرار، لذا تقدم كل ذرة هيدروجين إلكترونها إلى ذرة الأكسجين فتتكون رابطتين تساهميتين أحاديتين.
الرابطة التساهمية الثنائية Double Bond
تنشأ الرابطة التساهمية الثنائية بين ذرتين عندما تتشارك ذرتان بزوجين من الإلكترونات، وذلك بأن تقدم كل ذرة إلكترونين وتقدم الأخرى إلكترونين.
مثال:
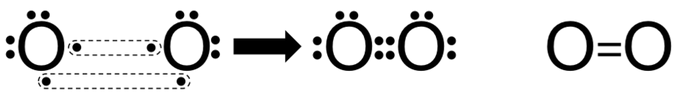
الرابطة في جزيء الأكسجين O2 .
تحتوي ذرة الأكسجين على ستة إلكترونات في الغلاف الخارجي.
8O : 1s2 2s2 2p4
انظر إلى تركيب لويس لذرة الأكسجين:

ولكي تصل ذرة الأكسجين إلى حالة الثبات، فإنها بحاجة إلى إلكترونين، فتتشارك ذرة الأكسجين الأولى بإلكترونين مع ذرة الأكسجين الثانية فتتكون رابطة مشتركة ثنائية.
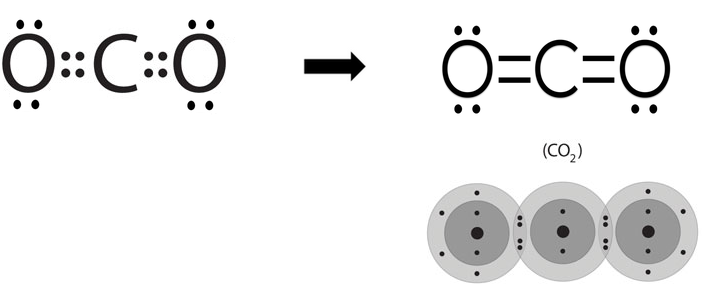
سؤال (1):
مثّل الرابطة الموجودة في جزيء ثاني أكسيد الكربون CO2 .
علماً بأن العدد الذري للكربون = 6 ، وللأكسجين = 8
الإجابة:
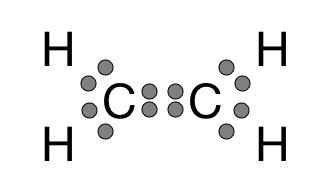
سؤال (2):
مثّل الرابطة الموجودة في جزيء الإيثين (الإيثيلين) C2H4 .
علماً بأن العدد الذري للهيدروجين = 1 ، وللكربون = 6
الإجابة:
الرابطة التساهمية الثلاثية Triple Bond
تنشأ الرابطة التساهمية الثلاثية بين ذرتين عندما تتشارك ذرتان بثلاثة أزواج من الإلكترونات، وذلك بأن تقدم كل ذرة ثلاثة إلكترونات وتقدم الأخرى ثلاثة إلكترونات.
مثال:
الرابطة في جزيء النتروجين N2 .
تحتوي ذرة النتروجين على خمسة إلكترونات في مستوى التكافؤ.
7N : 1s2 2s2 2p3
انظر إلى تركيب لويس لذرة النتروجين:
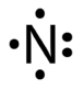
ولكي تصل ذرة النتروجين إلى حالة الثبات، فإنها بحاجة إلى ثلاثة إلكترونات، فتتشارك ذرة النتروجين الأولى بثلاثة إلكترونات مع ذرة النتروجين الثانية فتتكون رابطة تساهمية ثلاثية.
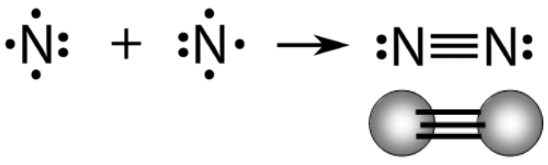
سؤال:
مثّل الرابطة الموجودة في جزيء الإيثاين (الأسيتلين) C2H2 .
علماً بأن العدد الذري للهيدروجين = 1 ، وللكربون = 6
سؤال:
وضح بالرسم أنواع الروابط التساهمية في مركب الميثانال H2CO وبين كيف وصل غلاف الذرات الأخير إلى حالة الاستقرار.
علماً بأن العدد الذري للهيدروجين = 1 ، وللكربون = 6 ، وللأكسجين = 8
إعداد : أ. أحمد الحسين
29 / 03 / 2022
النقاشات