نصف القطر الذري
Atomic Radius
لا يوجد حجم ثابت ومحدد للذرة، نظراً لأن الكثافة الإلكترونية لا تنتهي عند مسافة محددة من النواة، فالكثافة الإلكترونية تتغير من مكانٍ لآخر حول النواة.
ولكن كيف يمكن أن نقيس حجم الذرات إذا كان حجمها غير ثابت؟
حجم الذرات غير ثابت، ولكن المسافة بين أنوية الذرات المتماثلة ثابتة، لذا تم الاتفاق على قياس المسافة بين نوى الذرات المتجاورة في بلورة نقية من ذرات العنصر الصلب أو في جزيء العنصر الغازي، واعتبرت مقياساً للحجم الذري.
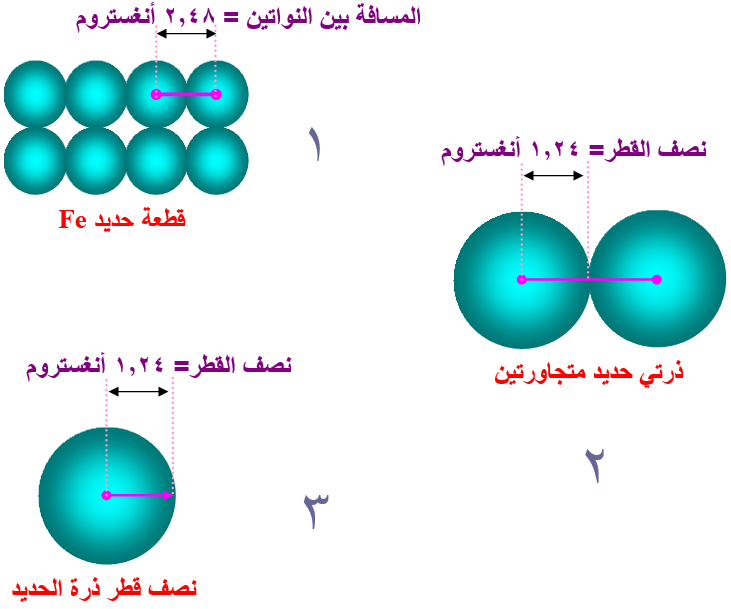
فمثلاً وجد أن المسافة بين ذرتي الحديد في قطعة من الحديد تساوي 2,48 أنغستروم، لذا اعتبر أن نصف القطر ذرة الحديد يساوي 1,24 أنغستروم.
ووجد أيضاً أن المسافة بين نواتي ذرتي اليود تساوي 2.66 أنغستروم ، لذا اعتبر أن نصف قطر ذرة اليود يساوي 1.33 أنغستروم .
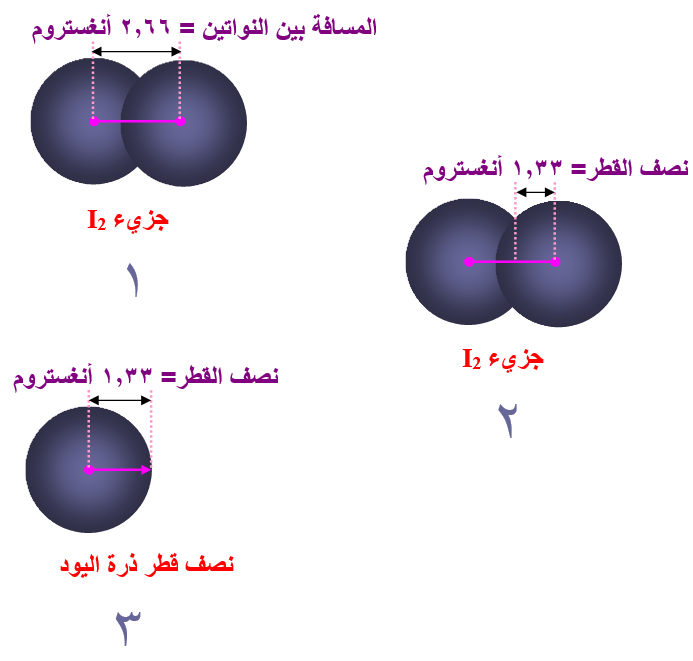
نصف القطر الذري: نصف المسافة الفاصلة بين ذرتين متجاورتين في البلورة الصلبة.
تغير نصف القطر والجحم الذري في الجدول الدوري
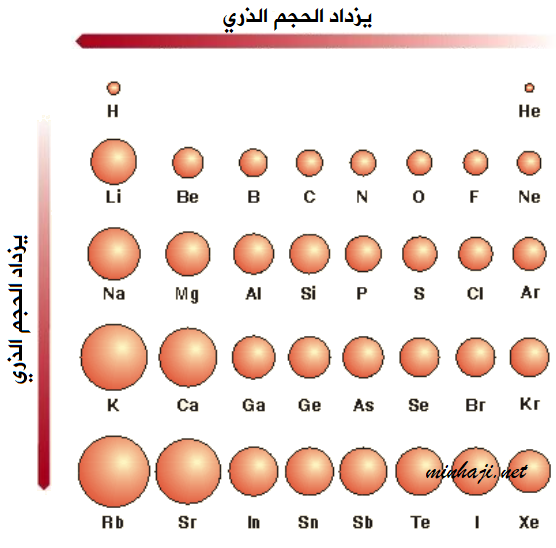
من الشكل تلاحظ:
- يزداد حجم الذرات بالانتقال من الأعلى إلى الأسفل في الجدول الدوري.
- يزداد حجم الذرات بالانتقال من اليمين إلى اليسار في الجدول الدوري.
سؤال:
بالرجوع إلى الجدول الدوري للعناصر، أي الذرات أصغر حجماً في الأزواج الآتية:
(F , Cl) ، (Na , Mg)؟
الإجابة:
الكلور أكبر حجماً من الفلور في الزوج الأول.
الصوديوم أكبر حجماً من المغنيسيوم في الزوج الثاني.
دورية نصف القطر الذري
انظر إلى نموذج الكرات التالي الذي يبين حجوم الذرات في الجدول الدوري:

لاحظ أن زيادة العدد الذري ضمن عناصر الدورة الواحدة يؤدي إلى نقصان الحجم الذري، بينما يزداد الحجم الذري ضمن عناصر المجموعة الواحدة بزيادة العدد الذري.
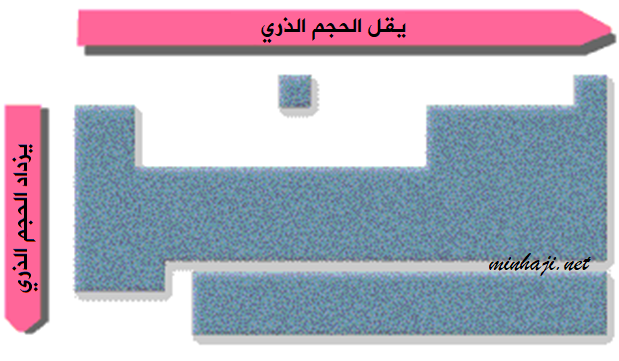
ولكن ما هي العوامل التي تؤدي إلى نقصان الحجم في الدورة الواحدة، وزيادته في المجموعة الواحدة؟
العوامل التي تحدد الحجم الذري
تتغير حجم الذرة بتأثير عاملين، هما:
- عدد الكم الرئيس.
- شحنة النواة الفعالة.
أولاً: عدد الكم الرئيس (n)
يزداد معدل بعد الإلكترون الأخير عن النواة بزيادة قيمة عدد الكم الرئيس (n)، فيزداد الحجم.
يستخدم هذا العامل لتفسير زيادة الحجم الذري لعناصر المجموعة الواحدة بزيادة العدد الذري.
سؤال:
أيهما أكبر حجماً ذرياً: ذرة الصوديوم أم ذرة البوتاسيوم؟
العدد الذري للصوديوم = 11 ، العدد الذري للبوتاسيوم = 19
الحل:
انظر إلى التركيب الإلكتروني لكل من الصوديوم والبوتاسيوم.
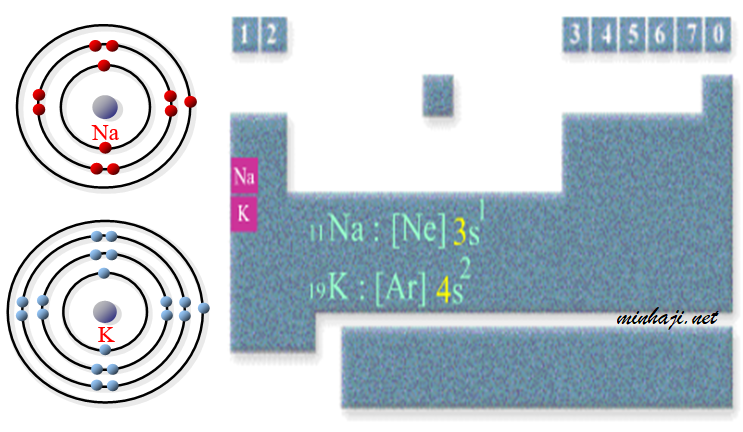
لاحظ أن الإلكترون الأخير في ذرة البوتاسيوم موجود في مستوى الطاقة الرابع الأبعد عن النواة من الإلكترون الأخير لذرة الصوديوم الموجود في مستوى الطاقة الرئيس الثالث، وعليه يكون حجم ذرة البوتاسيوم أكبر من حجم ذرة الصوديوم.
ثانياً: شحنة النواة الفاعلة
شحنة النواة الفاعلة: ذلك الجزء من شحنة النواة الذي تتأثر به الإلكترونات الخارجية.
وتعني أن الإلكترونات في الغلاف الخارجي لا تتأثر بكل الشحنة الموجبة في النواة (الشحنة الحقيقية) لأن إلكترونات المستويات الداخلية تقوم بحجب جزئي لشحنة النواة الموجبة عن الإلكترونات الخارجية.
مثال:
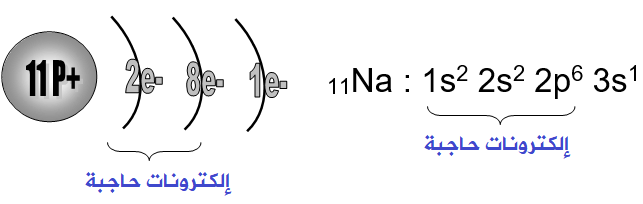
الإلكترون في الغلاف الخارجي للصوديوم يفصله عن النواة عشرة إلكترونات في الأغلفة الداخلية، وتقوم هذه الإلكترونات العشرة بحجب جزئي لشحنة النواة الموجبة عن الإلكترون الخارجي، لذا تكون الشحنة الموجبة التي تتأثر بها الإلكترونات الخارجية أقل من الشحنة الحقيقية للنواة.
وكلما كانت شحنة النواة الفاعلة أكبر كانت الإلكترونات الخارجية أكثر انجذاباً نحو النواة، فيقل الحجم.
ويستخدم هذا العامل لتفسير النقصان في الحجم الذري في الدورة الواحدة بزيادة العدد الذري، لأن زيادة العدد الذري في الدورة الواحدة يؤدي إلى زيادة عدد البروتونات مع ثبات عدد إلكترونات المستويات الداخلية الحاجبة.
ولا يستخدم هذا العامل لمقارنة حجوم عناصر المجموعة الواحدة لبقاء شحنة النواة الفعالة ثابتة تقريباً لعناصر المجموعة الواحدة، لأن ازدياد عدد البروتونات في النواة يقابلها زيادة مماثلة في عدد الإلكترونات الحاجبة.
سؤال:
أيهما أكبر حجماً الصوديوم أم المغنيسيوم؟
العدد الذري للصوديوم = 11 ، العدد الذري للمغنيسيوم= 12
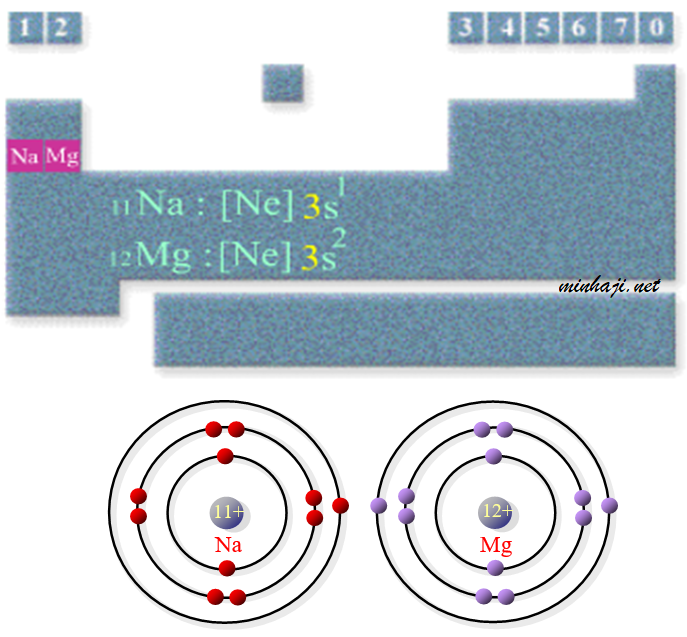
لاحظ أن ذرتي الصوديوم والمغنيسيوم تنتميان إلى الدورة نفسها (الدورة الثالثة) من الجدول الدوري، وعليه فإن الإلكترون الأخير في كلا الذرتين موجود في مستوى الطاقة الثالث ، إلا أن شحنة النواة الفاعلة في المغنيسيوم أكبر من شحنة النواة الفاعلة في ذرة الصوديوم، فالإلكترونات الخارجية في ذرة المغنيسيوم منجذبة إلى عدد أكبر من البروتونات، لذا يكون حجم ذرتها أصغر.
سؤال:
أيهما أكبر حجماً ذرياً:
- ذرة الكبريت ( ع.ذ = 16) أم ذرة الفسفور ( ع.ذ = 15) .
- ذرة الفلور ( ع.ذ = 9 ) أم ذرة الكلور ( ع.ذ = 17 ) .
الحل:
1-
16S:[Ne] 3s2 3p4
15P:[Ne] 3s2 3p3
كلاهما ينتمي للدورة نفسها؛ أي أن قيمة (n) ثابتة، إلا أن شحنة النواة الفاعلة لذرة الكبريت أكبر فالإلكترونات الخارجية في ذرة الكبريت منجذبة إلى عدد أكبر من البروتونات ، لذا يكون حجمها أصغر.
2-
9F:[He] 2s2 2p5
17Cl:[Ne] 3s2 3p5
يختلف العنصران في رقم الدورة، فعنصر الفلور ينتمي للدورة الثانية ( n=2 )، بينما ينتمي عنصر الكلور للدورة الثالثة ( n=3 )، لذا يكون الإلكترون الأخير في ذرة الكلور أبعد عن النواة من الإلكترون الأخير في ذرة الفلور، مع بقاء شحنة النواة الفاعلة ثابتة في كلا العنصرين، وعليه يكون حجم ذرة الكلور أكبر.
إعداد : شبكة منهاجي التعليمية
19 / 10 / 2020
النقاشات