 |
خامساً: تفاعلات الحموض والقواعد (تفاعلات التعادل)
Neutralization Reactions
تتفاعل محاليل الحموض مع محاليل القواعد لتعطي ملحاً وماءً، ويُعرف هذا التفاعل باسم تفاعل التعادل.
تفاعل التعادل: تفاعل بين الحمض والقاعدة ينتج عنه ملح وماء.
مثال:
تفاعل حمض الهيدروكلوريك مع محلول هيدروكسيد الصوديوم.
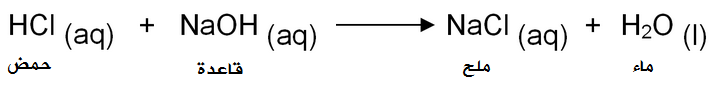
سؤال:
يتفاعل محلول هيدروكسيد البوتاسيوم KOH وحمض النيتريك HNO3 .
- اكتب معادلة التفاعل الحاصل.
- اذكر اسم الملح الناتج.
الحل:
- HNO3 + KOH → KNO3 + H2O
- نترات البوتاسيوم.
تفاعلات حموض وقواعد لا تحتوي على هيدروكسيد
أولاً: تفاعل الحموض مع الأمونيا يعطي ملح
مثال:
تفاعل الأمونيا (قاعدة) NH3 مع حمض الهيدروكلوريك HCl يعطي ملح كلوريد الأمونيوم.
NH3 + HCl → NH4Cl
ثانياً: تفاعل كربونات الفلز مع الحموض يعطي ملحاً وماءً وغاز ثاني أكسيد الكربون
مثال:
تفاعل كربونات الصوديوم مع حمض الهيدروكلوريك يعطي كلوريد الصوديوم (ملح) وماء وغاز ثاني أكسيد الكربون.
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
ثالثاً: تفاعل كربونات الفلز الهيدروجينية مع الحموض يعطي ملحاً وماءً وغاز ثاني أكسيد الكربون
مثال:
تفاعل كربونات الصوديوم الهيدروجينية مع حمض النيتريك يعطي نترات الصوديوم (ملح) وماء وغاز ثاني أكسيد الكربون.
NaHCO3 + HNO3 → NaNO3 + H2O + CO2
سؤال:
- يتفاعل حمض الكبريتيك H2SO4 مع كربونات المغنيسيوم الهيدروجينية Mg(HCO3)2 اكتب معادلة التفاعل، وما اسم الملح الناتج؟
- يلاحظ تصاعد غاز عند وضع قطرات من حمض HCl على قطع من الرخام، فسّر ذلك.
الحل:
- المعادلة:
Mg(HCO3)2 + H2SO4 → MgSO4 + 2H2O + 2CO2
الملح هو ملح كبريتات المغنيسيوم.
- يتكون الرخام من كربونات الكالسيوم (قاعدة) وعند تفاعله مع حمض HCl ينتج ملح كلوريد الكالسيوم وماء وغاز ثاني أكسيد الكربون.