 |
تفاعلات الإحلال الأحادي
Single Displacement Reaction
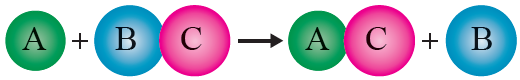
تفاعل الإحلال الأحادي: تفاعل يتم فيه إحلال عنصر نشط محل عنصر آخر أقل نشاطاً في أحد مركباته.
الصيغة العامة لتفاعل الإحلال الأحادي:
A + BC → AC + B
تقسم تفاعلات الإحلال الأحادي إلى ثلاثة أقسام، هي:
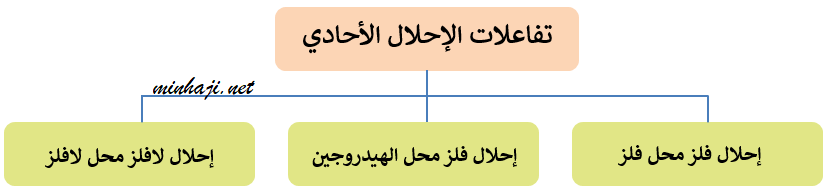
(1) إحلال فلز محل فلز آخر
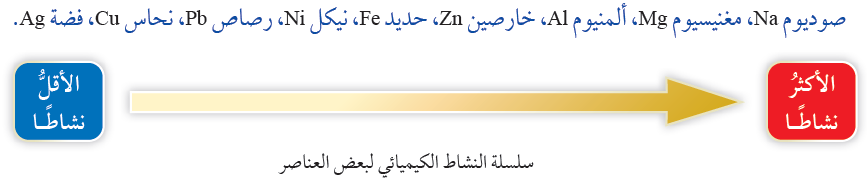
وفي هذا النوع من التفاعلات يحل الفلز النشط محل الفلز الأقل نشاطاً، ولمعرفة أي الفلز أنشط، يجب الرجوع إلى سلسلة نشاط الفلزات:
أمثلة:
- يحل فلز النحاس النشط محل فلز الفضة الأقل نشاطاً في محلول نترات الفضة:
Cu (s) + 2AgNO3 (aq) → Cu(NO3)2 (aq) + 2Ag (s)
- يحل فلز الألمنيوم النشط محل فلز الرصاص الأقل نشاطاً في محلول نترات الرصاص:
2Al (s) + 3Pb(NO3)2 (aq) → 2Al(NO3)3 (aq) + 3Pb (s)
- وفي تفاعلات الإحلال الأحادي يحل الفلز النشط محل الفلز الأقل نشاطاً، ولا يحدث العكس، فمثلاً يحل فلز المغنيسيوم الأكثر نشاطاً محل فلز النيكل الأقل نشاطاً في محلول كبريتات النيكل، ولا يحل النيكل محل المغنيسيوم في محلول كبريتات المغنيسيوم.
Mg (s) + NiSO4 (aq) → MgSO4 (aq) + Ni (s)
Ni (s) + MgSO4 (aq) → no reaction
(2) إحلال فلز محل الهيدروجين في الماء أو محلول الحمض
تحل معظم الفلزات محل الهيدروجين في الماء، أو محل الهيدروجين في محلول الحمض، ويتصاعد غاز الهيدروجين:
أمثلة:
- يحل الصوديوم محل الهيدروجين في الماء:
2Na (s) + 2H2O (l) → 2NaOH (aq) + H2 (g)
- يحل المغنيسيوم محل الهيدروجين في محلول الحمض:
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
(3) إحلال لافلز محل لافلز
من أبرز الأمثلة على هذه التفاعلات، إحلال الهالوجين الأكثر نشاطاً محل الهالوجين الأقل نشاطاً، ولمعرفة أي الهالوجينات أنشط، يجب الرجوع إلى ترتيب نشاط  الهالوجينات:
الهالوجينات:
مثال:
- يحل غاز الكلور الأكثر نشاطاً محل البروم الأقل نشاطاً في محلول بروميد الصوديوم، ولا يحدث العكس:
Cl2 (g) + 2NaBr (aq) → 2NaCl (aq) + Br2 (l)
Br2 (l) + 2NaCl (aq) → no reaction