 |
الرابطة الفلزية
Metallic Bond
ما الذي يربط ذرات قطعة حديد أو قطعة صوديوم مع بعضها؟

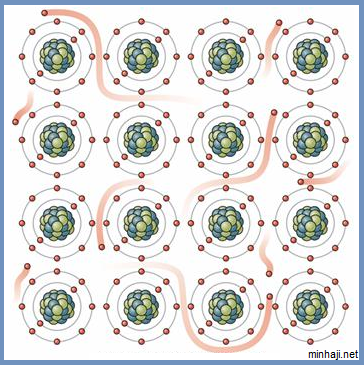
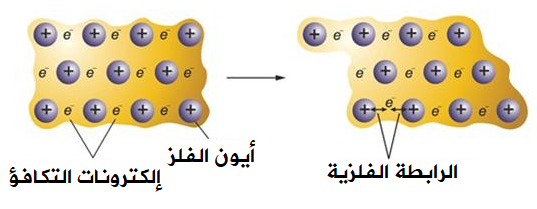
عندما تكون ذرات الفلز قريبة من بعضها، فإن كل ذرة تميل لفقد إلكترون أو أكثر من إلكترونات التكافؤ، ولكن تلك الإلكترونات تبقى حرة الحركة في بلورة الفلز، مما يؤدي إلى تخللها بين أيونات الفلز الموجبة والتي تمثل الأنوية، فتربط الإلكترونات أيونات الفلزات مع بعضها، ويتكون ما يعرف بالسحابة الإلكترونية، وتعرف هذه السحابة بالرابطة الفلزية.
انظر كيف يتحرك إلكترون الغلاف الخارجي لذرة الصوديوم بين أنوية ذرات الصوديوم.
خصائص الفلزات
أولاً: الصلابة
تمتاز جميع الفلزات بالصلابة (عدا الزئبق).
ثانياً: إيصاليتها للتيار الكهربائي
ويعود قدرة الفلزات على إيصال التيار الكهربائي إلى ترتيب السحابة الإلكترونية وحرية حركتها، فعند وصل الفلز بتيار كهربائي تتحرك إلكترونات الفلز باتجاه سريان التيار، فينتقل عبر الفلز.
ثالثاً: قابليتها للطرق والسحب
ويعود ذلك إلى أنه عند تعرض الفلز للطرق تنزلق صفوف الأيونات الموجبة عن بعضها، لكنها تبقى مترابطة من خلال السحابة الإلكترونية، فتبقى قوة جذب الأيونات الموجبة للسحابة دون تغيير.
رابعاً: النشاط الكيميائي
تمتاز الفلزات بنشاطها الكيميائي، وقدرتها على التفاعل مع المواد المختلفة، لذا فإن معظمها لا يوجد منفرداً في الطبيعة، باستثناء الفلزات غير النشطة كالذهب والفضة والبلاتين.