 |
مفهوم الاتزان الكيميائي
Chemical Equilibrium Concept
أنواع التفاعلات حسب اتجاه حدوثها
1- التفاعلات غير المنعكسة
التفاعلات غير المنعكسة: تفاعلات تسري باتجاه واحد نحو تكوين المواد الناتجة.
وفي هذا النوع من التفاعلات يسير التفاعل باتجاه واحد؛ من المتفاعلات إلى النواتج، ويعبر عنه بسهم باتجاه واحد.
مثال:
تفاعل احتراق المغنيسيوم.
MgO (s) → Mg (s) + O2 (g)
2- التفاعلات المنعكسة
التفاعلات المنعكسة: تفاعلات تحدث بالاتجاهين الأمامي والعكسي في الوقت نفسه.
وفي هذا النوع من التفاعلات يسير التفاعل باتجاهين؛ من المتفاعلات إلى النواتج، وبالعكس، ويعبر عنه بسهمين باتجاهين متعاكسين.
مثال:
تفاعل تحضير الأمونيا بتفاعل غازي النيتروجين والهيدروجين.
N2 (g) + 3H2 (g) 2NH3 (g)
مفهوم التفاعل الأمامي والتفاعل العكسي
التفاعل الأمامي: التفاعل الذي يحدث باتجاه تكوين المواد الناتجة في التفاعل المنعكس.
التفاعل العكسي: التفاعل الذي يحدث باتجاه تكوين المواد المتفاعلة في التفاعل المنعكس.
كيف تحدث التفاعلات المنعكسة؟
- في بداية التفاعل تكون تراكيز المتفاعلات أعلى ما يمكن، وتراكيز النواتج صفر.
- يبدأ التفاعل الأمامي بالحدوث، عندما تبدأ المواد المتفاعلة بالتفاعل معاً لتكوين النواتج، فتقل تراكيز المواد المتفاعلة وتقل سرعة التفاعل الأمامي.
- بمجرد تكون النواتج تبدأ بالتفاعل معاً وتعيد تكوين المواد المتفاعلة مرة أخرى، ويحدث التفاعل العكسي، وتبدأ تراكيز المواد الناتجة بالزيادة وسرعة التفاعل العكسي بالزيادة.
- يستمر التفاعل الأمامي والتفاعل العكسي بالحدوث إلى أن يصل التفاعل إلى حالة تسمى الاتزان الديناميكي.
مفهوم الاتزان الديناميكي
عند وصول التفاعلات المنعكسة إلى حالة الاتزان يحدث أمران:
- تصبح سرعة التفاعل الأمامي مساوية لسرعة التفاعل العكسي.
- تثبت تراكيز المواد المتفاعلة والمواد الناتجة.

انظر إلى الشكل التالي والذي يمثل ما يحدث لتراكيز المتفاعلات والنواتج، وسرعة التفاعل الأمامي والعكسي قبل وبعد الوصول إلى وضع الاتزان:
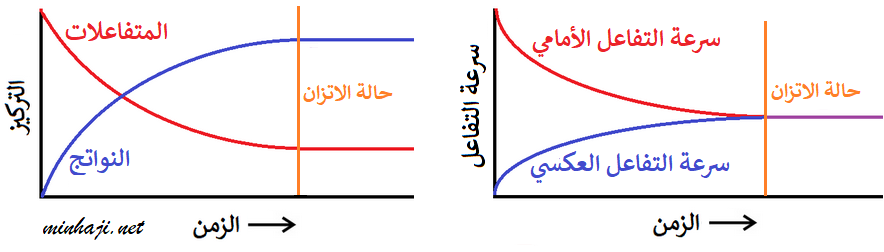
وعليه يعرف الاتزان الديناميكي على النحو الآتي:
الاتزان الديناميكي: حالة يصل إليها التفاعل ويستمر عندها حدوث التفاعل بالاتجاهين الأمامي والعكسي بالسرعة نفسها.