 |
النماذج الذرية
Atomic Models Evolution
أولاً: نموذج دالتون Dalton’s Model
وضع دالتون أول نظرية عن تركيب الذرة، وافترض ما يلي:
- يتألف العنصر من جسيمات صغيرة جداً، لا تتجزأ، تُسمى الذرات.
- تتشابه ذرات العنصر الواحد في الخواص وتتساوى في الكتلة.
- تختلف ذرات العناصر المختلفة في الخواص والكتل.
- تتفاعل ذرات العناصر مع بعضها بنسب ثابتة لتكوين المركبات.
أسباب رفض النظرية
نجحت النظرية في تفسير قوانين الاتحاد الكيميائي، ولكنها اعتمدت في الاستنتاجات المباشرة ولم تعتمد على التجارب.
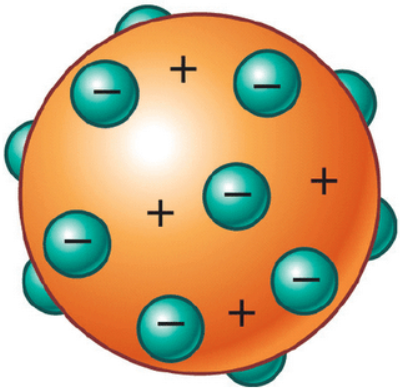
ثانياً: نموذج طومسون Thomson’s Model
أجرى طومسون تجارب على التفريغ الكهربائي خلال الغازات داخل أنبوب زجاجي. وافترض أن الذرة كرة مصمتة تتوزع على سطحها جسيمات سالبة الشحنة.
أسباب رفض النموذج
- افترض طومسون أن الذرة كرة مصمتة، وهي فعلياً ليست مصمتة.
- لم يستطع النموذج تفسير الكثير من المشاهدات الفيزيائية المتعلقة بالذرات وخواصّها.
- لم يشر النموذج إلى حركة الإلكترون أو شحنته.
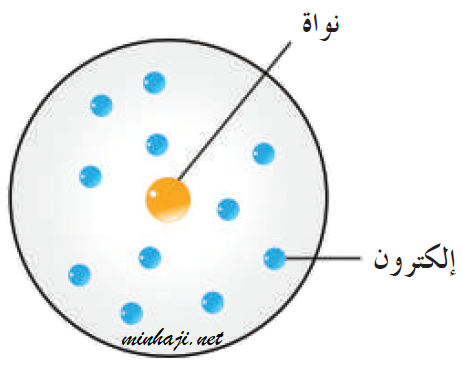
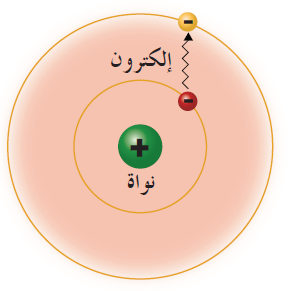
ثالثاً: نموذج رذرفورد Rutherford’s Model
بمساعدة جيجر ومارسيديان، أرسل رذرفورد سيل من جسيمات ألفا الموجبة على شريحة رقيقة من الذهب، وخرج بالافتراضات التالية:
- تدور الإلكترونات سالبة الشحنة حول نواة مركزية، كما تتحرك الكواكب حول الشمس.
- معظم الذرة فراغ، وتتركز فيها نواة صغيرة الحجم.
- تتركز كتلة الذرة في نواتها؛ لأن كتلة الإلكترونات صغير جداً مقارنة بكتلة البروتونات والنيوترونات.
- تحتوي النواة على بروتونات موجبة الشحنة (لم تكن النيوترونات مكتشفة بعد)، وتتوزع الإلكترونات سالبة الشحنة حول النواة.
- الذرة متعادلة كهربائياً؛ لأن عدد الشحنات الموجبة يساوي عدد الشحنات السالبة.
- تدور الإلكترونات حول النواة في مدارات خاصة.
- عندما يدور الإلكترون حول النواة يتعرض لقوتين، الأولى قوة تجاذبه مع النواة، والثانية القوة المركزية الناشئة عن دوران الإلكترونات.
أسباب رفض النظرية
قوانين الفيزياء السائدة في ذلك الوقت أشارت إلى أن الإلكترون عندما يدور حول النواة سيتعرض لقوة جذب منها يؤدي إلى سقوط الإلكترونات في النهاية نحو النواة، وهذا يعني أن النموذج الذري لرذرفورد غير ثابت.
رابعاً: نموذج بور Bohr’s Model
درس بور الطيف الخطي لذرة الهيدروجين، ووضع نموذجاً ذرياً افترض فيه:
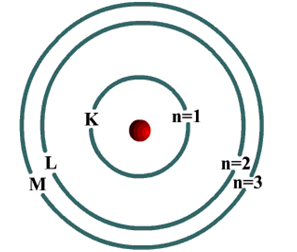 يدور الإلكترون حول النواة في مدار ثابت.
يدور الإلكترون حول النواة في مدار ثابت.- للذرة عدد من المدارات، ولكل مدار منها نصف قطر ثابت وطاقة محددة، ويمثل كل مدار مستوى معيناً من الطاقة يشار إليه بالحرف (n) الذي يأخذ قيماً عددية صحيحة ...... ، 4 ، 3 ، 2 ، 1 = n
- لا يشع الإلكترون الطاقة ولا يمتصها ما دام يدور في المدار نفسه حول النواة.
- يمكن للإلكترون أن ينتقل من مستوى طاقة إلى مستوى طاقة آخر، إذا غيّر من طاقته بما يتناسب مع طاقة المستوى الجديد، فعند إثارة الذرة يمتص الإلكترون طاقة ليقفز إلى مستوى طاقة أعلى، في حين يشع طاقة إذا انتقل إلى مستوى طاقة أدنى، فيتكون عندئذ طيف الإشعاع الخطي.
عيوب نظرية بور
فشلت النظرية في تفسير أطياف العناصر الأثقل من الهيدروجين.