 |
الخصائص الفيزيائية والكيميائية للألكينات
الخصائص الفيزيائية
تتشابه الألكينات في خصائصها الفيزيائية مع الألكانات.
الذائبية في الماء
لا تذوب الألكينات في الماء؛ لكونها مركبات غير قطبية.
درجات الغليان
درجات غليان الألكينات منخفضة؛ لوجود قوى لندن الضعيفة بين جزيئاتها، وتزداد درجات غليان الألكين بزيادة عدد ذرات الكربون فيه (الكتلة المولية).
الحالة الفيزيائية
الألكينات الثلاثة الأولى غازية، ثم تصبح سائلة إلى الألكين الذي يحتوي على 15 ذرة كربون، ثم تصبح صلبة؛ والسبب في ذلك يعود لزيادة قوى لندن بزيادة عدد ذرات الكربون (الكتلة المولية) فتتحول الألكينات من الحالة الغازية إلى السائلة ومن ثم الصلبة.
الخصائص الكيميائية
الألكينات أنشط من الألكانات، لاحتواء الرابطة الثنائية فيها على رابطة ضعيفة من نوع باي (π) التي يسهل كسرها أثناء التفاعل.
الاحتراق
يحترق الألكين بوجود الأكسجين، وينتج من احتراقه غاز ثاني أكسيد الكربون وبخار الماء وكمية من الطاقة.
مثال:
تفاعل احتراق الإيثين C2H4 :
C2H4 + 3O2 → 2CO2 + 2H2O + heat
أكسدة الألكينات
تتأكسد الألكينات باستخدام محلول بيرمنغنات البوتاسيوم KMnO4 البارد ذي اللون البنفسجي، فتكسر الرابطة الثنائية وينتج مركب عضوي يحتوي على مجموعتي هيدروكسيل (OH)، ويتكون راسب بني محمر من أكسيد المنغنيز MnO2 .
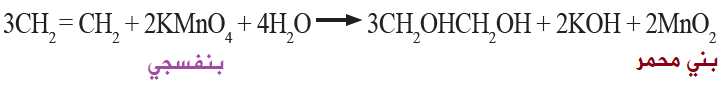
يستخدم هذا التفاعل للتمييز بين الألكانات والألكينات، حيث يتفاعل الألكين ويغير لون البيرمنغنات البنفسجي إلى بني محمر، بينما يبقى لون البيرمنغنات بنفسجي مع الألكان دلالة على عدم تفاعله.
تفاعلات الإضافة
تحدث تفاعلات الإضافة في الألكين على الرابطة الثنائية، فتنكسر رابطة باي وتتكون رابطتي سيجما على ذرتي كربون الرابطة الثنائية، وينتج مركب مشبع.
من أمثلة تفاعلات الإضافة في الألكينات تفاعل إضافة الهيدروجين إلى الألكين بوجود النيكل أو البلاتين كعامل مساعد ويتكون الألكان المقابل.
مثال:
إضافة الهيدروجين إلى الإيثين لتكوين الإيثان:
CH2 = CH2 + H2 CH3CH3