أسئلة مراجعة الوحدة الثانية
السؤال الأول:
الفكرة الرئيسة: أوضّح المقصود بالمفاهيم والمصطلحات الآتية:
شحنة النواة الفعالة، الحجم الأيوني، طاقة التأين الثانية.
السؤال الثاني:
أكتب التوزيع الإلكتروني لكل عنصر من العناصر الآتية: S ، Mn ، Ge ، Cu بدلالة العنصر النبيل المناسب لكل منها، ثم أجيب عمّا يأتي:
أ- ما رقم الدورة ورقم المجموعة لكل عنصر من هذه العناصر؟
ب- ما عدد الإلكترونات المنفردة في ذرة كلّ منها؟
ج- ما عدد إلكترونات التكافؤ في ذرة العنصر S ؟
د- ما أكبر عدد من الإلكترونات التي لها اتجاه الغزل نفسه في المستوى الخارجي لذرة Ge ؟
هـ- ما أكبر عدد من الإلكترونات التي لها اتجاه الغزل نفسه في ذرة S ؟
و- أكتب التوزيع الإلكتروني لكل من: S2- ، و Mn4+ .
السؤال الثالث:
أكتب التوزيع الإلكتروني لعنصر:
أ- من الدورة الثالثة، والمجموعة الرابعة عشرة.
ب- من الدورة الرابعة، والمجموعة السادسة B .
ج- ينتهي توزيعه الإلكتروني بالمستوى الفرعي 4p2 .
د- ينتهي التوزيع الإلكتروني لأيونه الثنائي السالب بالمستوى الفرعي 3p6 .
هـ- ينتهي التوزيع الإلكتروني لأيونه الثلاثي الموجب بالمستوى الفرعي 3d2 .
السؤال الرابع:
أحدد أكبر ذرة حجماً في كل زوجٍ من الأزواج الآتية: (Mg , Na) ، (Si , C) ، (F , Cl).
السؤال الخامس:
أحدد الأصغر حجماً في كل من الأزواج الآتية: (Ca , Ca2+) ، (S , S2-) ، (O2- , Mg2+).
السؤال السادس:
أي الذرات تملك أعلى طاقة تأين أولى في الأزواج الآتية: (Na , K) ، (N , Be) ، (He , Ne).
السؤال السابع:
أفسّر:
أ- تتناقص حجوم الذرات في الدورة الثالثة بالاتجاه من اليسار إلى اليمين في الجدول الدوري.
ب- تتناقص طاقة تأين عناصر المجموعة الواحدة بالاتجاه من الأعلى إلى الأسفل في الجدول الدوري.
ج- تزداد حجوم الأيونات السالبة مقارنة بحجوم ذراتها.
السؤال الثامن:
أدرس الجدول الآتي، ثم أجيب عن الأسئلة التي تليه:
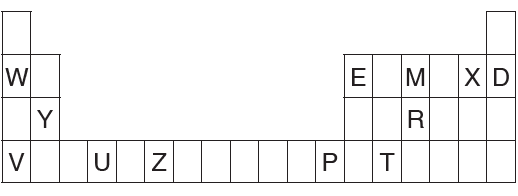
أ- أكتب التوزيع الإلكتروني لكل ذرةٍ من ذرات العناصر الآتية: Z , Y , M .
ب- ما رقم مجموعة كل عنصر من العناصر الآتية: U , X , V .
ج- ما العدد الذري لعنصر من دورة العنصر V ، ومجموعة العنصر E ؟
د- ما عدد الإلكترونات المنفردة في المستوى الخارجي لذرة العنصر R ؟
و- أي العناصر الآتية حجمه الذري أكبر: E أم R أم V ؟
ز- أي العناصر الآتية طاقة تأينه الثانية أعلى: M أم Y أم R ؟
ح- أي العناصر الآتية له أقل سالبية كهربائية: E أم X أم M ؟
السؤال التاسع:
أكتب التوزيع الإلكتروني للعناصر الآتية، ثم أجيب عن الأسئلة التي تليها:
23V , 17Cl , 12Mg , 11Na , 10Ne , 8O , 7N
أ- ما عدد الإلكترونات المنفردة في كل عنصر من العناصر الآتية: Mg , Cl , N .
ب- أكتب التوزيع الإلكتروني للأيون V2+ .
ج- أي العنصرين طاقة تأينه أقل: Mg أم Na ؟
د- أي العنصرين حجمه الذري أكبر: O أم Cl ؟
هـ- أي هذه العناصر له أعلى طاقة تأين ثانية؟
و- أي هذه العناصر له أعلى سالبية كهربائية؟
السؤال العاشر:
العنصر X هو من عناصر الدورة الثانية، وقيم طاقة التأين له:
ط1 = 900، ط2 = 1757، ط3 = 14850، ط4 = 21007
أ- أحدد رقم مجموعة العنصر X .
ب- أكتب التوزيع الإلكتروني للأيون X + .
السؤال الحادي عشر:
أدرس في ما يأتي العناصر الافتراضية المتتالية في عددها الذري بالجدول الدوري، ثم أجيب عن الأسئلة التي تليها:
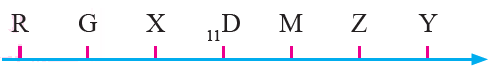
أ- أكتب التوزيع الإلكتروني لذرة العنصر X .
ب- ما مجموعة كل عنصر من العناصر الآتية: R , D , Y ؟
ج- أي هذه العناصر له أعلى طاقة تأين ثالثة؟
د- أي هذه العناصر له أقل طاقة تأين؟
هـ- أي هذه العناصر أعلى سالبية كهربائية؟
و- أعمل رسماً بيانياً يمثل تغير طاقة التأين لهذه العناصر بزيادة العدد الذري.
السؤال الثاني عشر:
تُستخدم مركبات الباريوم ومركبات اليود بوصفها مواد تباين (مظللة) في التصوير بالأشعة السينية الملونة لبعض الأعضاء الداخلية والأوعية الدموية في الجسم، فهي تكسبها لوناً مميزاً؛ ما يجعل تصويرها واضحاً. أكتب التوزيع الإلكتروني لكل من الباريوم (Ba) واليود (I)، ثم أحدد موقع كل منهما (رقم الدورة، ورقم المجموعة) في الجدول الدوري.
السؤال الثالث عشر:
أضع دائرة حول رمز الإجابة الصحيحة لكل جملةٍ ممّا يأتي:
1- المستوى الفرعي الذي يملأ أولاً بالإلكترونات هو:
أ- 4d .
ب- 4p .
ج- 5p .
د- 5s .
2- عدد البروتونات في الذرة التي تركيبها الإلكتروني [Ne] 3s2 3p4 هو:
أ- (6) بروتوناتٍ.
ب- (8) بروتوناتٍ.
ج- (16) بروتوناً.
د- (24) بروتوناً.
3- يُعد العنصر انتقالياً داخلياً إذا انتهى توزيعه الإلكتروني بأفلاك المستوى الفرعي:
أ- s .
ب- p .
ج- d .
د- f .
4- عدد إلكترونات التكافؤ لذرة تركيبها الإلكتروني 1s2 2s2 2p6 3s2 3p4 هو:
أ- إلكترونان.
ب- (4) إلكتروناتٍ.
ج- (6) إلكتروناتٍ.
د- (16) إلكتروناً.
5- أصغر حجماً من الذرات الآتية هي:
أ- 14Si .
ب- 16S .
ج- 20Ca .
د- 32Ge .
6- الذرة التي لها أعلى طاقة تأين ثالثة من الذرات الآتية هي:
أ- 17Cl .
ب- 13Al .
ج- 19K .
د- 20Ca .
7- المعادلة التي تمثل طاقة التأين الرابعة للمغنيسيوم هي:
أ- Mg4+(s) + 4e →Mg(g)
ب- Mg4+(g) + e →Mg3+(g)
ج- Mg3+(g) + e → Mg2+(g)
د- Mg5+(g) + e → Mg4+(g)
8- تشير الطاقة في المعادلة:
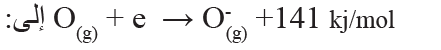
أ- طاقة التأين للأكسجين.
ب- الكهروسلبية للأكسجين.
ج- الألفة الإلكترونية للأكسجين.
د- طاقة التأين الثانية للأكسجين.
إعداد : شبكة منهاجي التعليمية
31 / 10 / 2021
النقاشات