إجابات مراجعة الدرس
الحموض والقواعد
1- أوضح المقصود بكل ممّا يأتي:
- حمض أرهينيوس.
- حمض برونستد - لوري.
- قاعدة لويس.
- مادة أمفوتيرية.
حمض أرهينيوس: مادة تتأين في الماء وتنتج أيون الهيدروجين (+H).
حمض برونستد - لوري: مادة يمكنها منح بروتون واحد أو أكثر في أثناء التفاعل (مانح للبروتون).
قاعدة لويس: مادة تستطيع أن تعطي زوجاً (أو أكثر) من الإلكترونات غير الرابطة.
المواد الأمفوتيرية: مواد تستطيع أن تتفاعل كحمض أو كقاعدة تبعاً للظروف الموجودة فيها.
2- أكمل الجدول الآتي باستخدام الأسس التي اعتمد عليها مفهوم الحمض والقاعدة:

3- أفسر:
- السلوك الحمضي لمحلول حمض HClO حسب مفهوم أرهينيوس.
لأنه يتأين في الماء وينتج أيون الهيدروجين (H+).
- السلوك القاعدي لمحلول C2H5NH2 حسب مفهوم برونستد - لوري.
لأنها تستقبل بروتون من الحمض أثناء التفاعل.
- يعد الحمض HBr حمضاً قوياً بينما يعد HNO2 حمضاً ضعيفاً.
الحمض HBr حمض قوي؛ لأنه أكثر قدرة على منح البروتون من الحمض H3O+ ، والقاعدة Cl- أقل قدرة على استقبال البروتون من القاعدة H2O .
الحمض HNO2 حمض ضعيف؛ لأنه أقل قدرة على منح البروتون من الحمض H3O+ ، والقاعدة NO2- أكثر قدرة على استقبال البروتون من القاعدة H2O .
4- أصنف المحاليل الآتية إلى حموض وقواعد قوية أو ضعيفة:
H2SO3 , HI , KOH , HF , NH3 , N2H4
H2SO3 , HF : حمضان ضعيفان.
HI : حمض قوي.
KOH : قاعدة قوية.
NH3 , N2H4 : قاعدتان ضعيفتان.
5- أحدد الأزواج المترافقة في التفاعلين الآتيين:
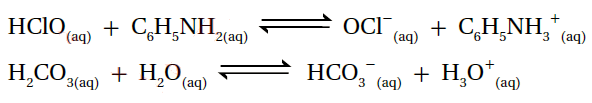
المعادلة الأولى: الزوج الأول (HClO/OCl-)، والزوج الثاني (C6H5NH2/C6H5NH3+).
المعادلة الثانية: الزوج الأول (H2CO3/HCO3-)، والزوج الثاني (H2O/H3O+).
6- أحدد الحمض والقاعدة وفق مفهوم لويس في المعادلة الآتية:
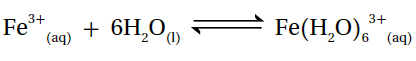
الحمض (Fe3+)، والقاعدة (H2O).
7- أفسر السلوك الأمفوتيري للأيون H2PO4- عند تفاعله مع كل من HNO3 و CN- ، موضحاً إجابتي بالمعادلات.
يسلك الأيون H2PO4- كقاعدة عند تفاعله مع الحمض HNO3 ؛ لأن له القدرة على استقبال بروتون من HNO3 .
H2PO4- (aq) + HNO3 (aq) H3PO4 (aq) + NO3- (aq)
يسلك الأيون H2PO4- كحمض عند تفاعله مع القاعدة CN- ؛ لأن له القدرة على منح بروتون للقاعدة CN- .
H2PO4- (aq) + CN- (aq) HPO42- (aq) + HCN (aq)
إعداد : شبكة منهاجي التعليمية
31 / 07 / 2022
النقاشات