إجابات أسئلة مراجعة الدرس
السؤال الأول:
الفكرة الرئيسة: كيف تنتج الخلية الجلفانية الطاقة الكهربائية؟
تنتج الخلية الجلفانية الطاقة الكهربائية عن طريق تفاعل التأكسد والاختزال اللذان يحدثان على قطبي المصعد والمهبط.
السؤال الثاني:
أوضح المقصود بكل من:
- القنطرة الملحية.
- جهد الاختزال المعياري.
القنطرة الملحية: أنبوب زجاجي على شكل حرف (U) يحتوي على محلول مشبع لأحد الأملاح، يصل بين نصفي الخلية الجلفانية؛ ويحافظ على شحناتها الكهربائية.
جهد الاختزال المعياري: مقياس لميل نصف تفاعل الاختزال للحدوث في الظروف المعيارية.
السؤال الثالث:
خلية جلفانية يحدث فيها التفاعل الآتي:
Co + Cu2+ → Co2+ + Cu
أ- أحدد فيها المصعد والمهبط.
المصعد: Co ، والمهبط: Cu
ب- أكتب نصفي تفاعل التأكسد والاختزال.
نصف تفاعل التأكسد: Co → Co2+ + 2e-
نصف تفاعل الاختزال: Cu2+ + 2e- → Cu
ج- أحسب جهد الخلية المعياري، وأكتب تعبيراً رمزياً للخلية الجلفانية.
E0cell = E0(cathode) – E0(anode)
E0cell = + 0.34 – (- 0.27) = + 0.61 V
أكتب تعبيراً رمزياً للخلية الجلفانية:
Cu(s)│Cu2+(aq) ││ Co2+(aq)│Co(s)
د- ما التغير الذي يحدث لكتلة كلا القطبين؟
تقل كتلة الكوبالت، وتزداد كتلة قطب النحاس.
السؤال الرابع:
نصفا التفاعل الآتيان يشكلان خلية جلفانية في الظروف المعيارية:
I2 (s) + 2e- → 2I- Eo = 0.54 V
Fe2+ (aq) + 2e- → Fe (s) Eo = - 0.44 V
أجيب عن الأسئلة الآتية المتعلقة بهما:
أ- أكتب معادلة التفاعل الكلي في الخلية.
Fe + I2 → Fe2+ + 2I-
ب- أحسب جهد الخلية المعياري.
E0cell = E0(cathode) – E0(anode)
E0cell = + 0.54 – (- 0.44) = + 0.98 V
ج- ما التغير الذي يحدث لتركيز أيونات كل من I- و Fe2+ ؟
يزداد تركيز أيونات Fe2+ ، ويزداد تركيز أيونات I- .
السؤال الخامس:
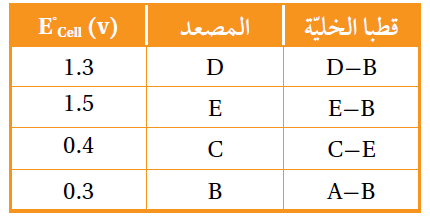 أدرس الجدول الآتي، الذي يوضح جهد الخلية المعياري لعدد من الخلايا الجلفانية المكونة من الفلزات ذوات الرموز (A,B,C,D,E)، وجميعها تكون أيونات ثنائية موجبة، ثم أجيب عن الأسئلة الآتية:
أدرس الجدول الآتي، الذي يوضح جهد الخلية المعياري لعدد من الخلايا الجلفانية المكونة من الفلزات ذوات الرموز (A,B,C,D,E)، وجميعها تكون أيونات ثنائية موجبة، ثم أجيب عن الأسئلة الآتية:
أ- أحدد الفلز الذي له أعلى جهد اختزال معياري: D أم C .
D
ب- أحدد أقوى عامل مؤكسد.
A2+
ج- أتنبأ: هل يمكن تحريك محلول نترات E بملعقة من A ؟ أفسر إجابتي.
يمكن تحريك المحلول.
التفاعل المراد التنبؤ بحدوثه:
A + E(NO3)2 → E + A(NO3)2
بما أن جهد اختزال A أعلى من جهد اختزال E ؛ إذن التفاعل السابق لا يحدث بشكل تلقائي.
د- أحدد اتجاه حركة الإلكترونات عبر الأسلاك في الخلية الجلفانية المكونة من نصف خلية E2+│E ونصف خلية D│D2+ .
تتحرك الإلكترونات من قطب E إلى قطب D .
هـ- أحسب جهد الخلية المعياري للخلية الجلفانية المكونة من نصف خلية C│C2+ ونصف خلية B│B2+ .
1.9 V
السؤال السادس:
فلزان أعطيا الرموز الافتراضية A و B ، قيست جهود الاختزال المعيارية لنصفي الاختزال المعياريين المكونين لخلية جلفانية كالآتي:
A3+ + e- → A2+ Eo = 0.77 V
B+ + e- → B Eo = 0.80 V
أ- أكتب معادلة كيميائية للتفاعل الكلي في الخلية الجلفانية.
A2+ + B+ → A3+ + B
ب- أحسب Eo للتفاعل الكلي.
E0cell = E0(cathode) – E0(anode)
E0cell = + 0.80 – (0.77) = + 0.03 V
ج- أحدد العامل المؤكسد والعامل المختزل في التفاعل.
العامل المؤكسد: B+ ، العامل المختزل: A2+
السؤال السابع:
أدرس الجدول المجاور الذي يمثل جهود الاختزال المعيارية لبعض المواد، ثم أجيب عن الأسئلة الآتية:
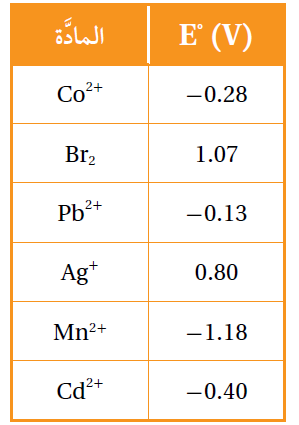 أ- أحدد أقوى عامل مؤكسد وأقوى عامل مختزل.
أ- أحدد أقوى عامل مؤكسد وأقوى عامل مختزل.
أقوى عامل مؤكسد: Br2 ، أقوى عامل مختزل: Mn
ب- أستنتج. هل يمكن حفظ محلول البروم Br2 في وعاء من الفضة؟ أفسر إجابتي.
التفاعل المراد التنبؤ بحدوثه:
Ag + Br2 → Ag+ + 2Br-
E0cell = E0(cathode) – E0(anode)
E0cell = + 1.06 – (0.80) = + 0.26 V
جهد التفاعل موجب، فالتفاعل قابل للحدوث؛ إذن لا يمكن حفظ البروم في وعاء من الفضة.
ج- أقارن. ما الفلزين اللذين يكونان خلية جلفانية لها أكبر جهد خلية معياري؟.
Ag / Mn
د- أستنتج المادة التي تستطيع أكسدة Cd ولا تؤكسد Pb .
Co
هـ- أحدد القطب الذي تزداد كتلته في الخلية الجلفانية (Cd-Pb).
Pb
و- أحدد الفلز الذي لا يحرر غاز الهيدروجين من محلول حمض HCl المخفف.
Ag
ز- في الخلية الجلفانية التي أعطيت الرمز الآتي:
Co(s)│Co2+(aq)││Sc3+(aq)│Sc(s)
إذا علمت أن جهد الخلية المعياري Eocell = 1.8 V ، فأجيب عن الأسئلة الآتية:
أ- أحدد اتجاه حركة الإلكترونات عبر الأسلاك في الخلية.
من قطب Sc إلى قطب Co .
ب- أحسب جهد الاختزال المعياري لقطب السكانديوم Sc .
E0cell = E0(cathode) – E0(anode)
1.8 = - 0.28 – (E0(Sc))
E0Sc = - 2.08 V
ج- أكتب معادلة التفاعل الكلي في الخلية.
2Sc + 3Co2+ → 2Sc3+ 2Co2+
إعداد : شبكة منهاجي التعليمية
22 / 06 / 2023
النقاشات