إجابات أسئلة مراجعة الدرس
الروابط الكيميائية
السؤال الأول:
الفكرة الرئيسة: كيف تتكون الروابط الكيميائية بين ذرات العناصر؟
من خلال فقد الذرة للإلكترونات، أو اكتسابها، أو المشاركة بها.
السؤال الثاني:
أستخدم الجدول الدوري، وأحدد نوع الرابطة بين ذرة الليثيوم وذرة الفلور.
رابطة أيونية.
السؤال الثالث:
أوضّح باستخدام رموز لويس كيف تنشأ الرابطة الأيونية بين المغنيسيوم والكلور.

السؤال الرابع:
أفسر: توصل محاليل المركبات الأيونية التيار الكهربائي.
لاحتوائها على أيونات موجبة وسالبة.
السؤال الخامس:
أقارن بين المركبات الأيونية والتساهمية من حيث: درجة الغليان والانصهار، والتوصيل الكهربائي.
|
وجه المقارنة |
المركبات الأيونية |
المركبات التساهمية |
|
درجة الغليان والانصهار |
مرتفعة |
منخفضة |
|
التوصيل الكهربائي |
غير موصلة للتيار الكهربائي في الحالة الصلبة، لكن مصاهيرها ومحاليلها موصلة |
غالبية مركباتها غير موصلة |
السؤال السادس:
أطرح سؤالاً إجابته قوة الرابطة الأيونية.
لماذا تمتاز المركبات الأيونية بارتفاع درجات غليانها وانصهارها؟
السؤال السابع:
أستنتج: ما أنواع الروابط التي تنشأ بين كل من الذرات الآتية: (الصوديوم والكبريت)، (الفلور والفلور).
- الصوديوم والكبريت: أيونية.
- الفلور والفلور: تساهمية.
السؤال الثامن:
يتكون جزيء HCl من ارتباط ذرة هيدروجين بذرة كلور، أبين بالرسم هذا الترابط.
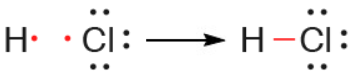
السؤال التاسع:
أكتب الصيغة الكيميائية للمركبات الآتية: نترات الصوديوم، وكبريتات المغنيسيوم.
- نترات الصوديوم: NaNO3
- كبريتات المغنيسيوم: MgSO4
السؤال العاشر:
التفكير الناقد: يحتوي السيليكون أربعة إلكترونات في مستوى التكافؤ، فما الرابطة التي يكونها السيليكون مع الذرات الأخرى؟ أوضّح إجابتي.
رابطة تساهمية.
بما أن السيليكون يحتوي على أربع إلكترونات في مستوى التكافؤ؛ فإنه يميل لأن يتشارك مع أربع إلكترونات من ذرات أخرى، وبذلك تتكون الرابطة التساهمية.
تطبيق الرياضيات
يبين الجدول الآتي درجاتِ انصهار وغليان بعض المركبات الأيونية والجزيئية (التساهمية):
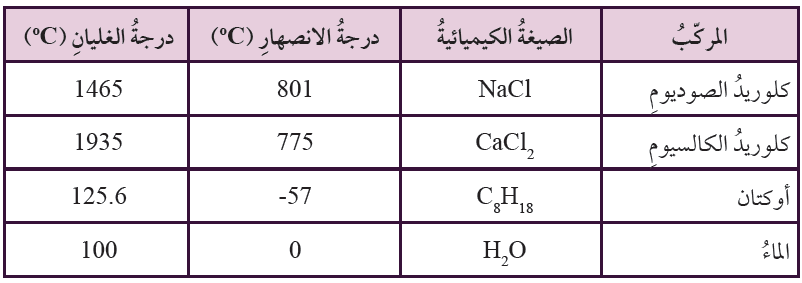
1- أرسم بيانياً مخطط أعمدة Bar Graph لدرجات انصهار هذه المركبات، على أن أرتب الأعمدة تصاعدياً، ثم أسمي كل عمود بالصيغة الكيميائية للمركب.
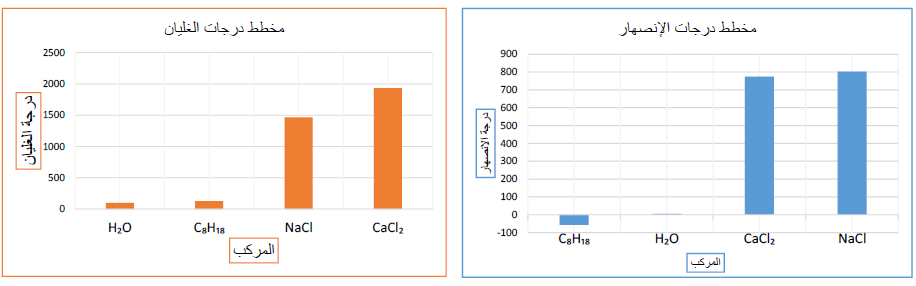
2- أصنفُ المركباتِ إلى أيونية وتساهمية، وأحدّد أيهما أعلى درجة غليان ودرجة انصهار.
المركبات الأيونية: كلوريد الصوديوم، كلوريد الكالسيوم.
المركبات الجزيئية (التساهمية): أوكتان، الماء.
أعلى درجة غليان: كلوريد الكالسيوم، أعلى درجة انصهار، كلوريد الصوديوم.
إعداد : شبكة منهاجي التعليمية
08 / 04 / 2023
النقاشات
محمد عيد
برووو احلى موقع اذا بدك تخلص من واجباتك
إضافة رد
1 ردود
تقي الدين زيوت
أنهيت تجبي بوقت قصير يعطيهم العافية يا رجال والله احلى موقع مين بوافق؟