الضغط البخاري
Vapour Pressure
عند وضع سائل في وعاء مكشوف فإنه يتبخر باستمرار.
ولكن عند وضع سائل في وعاء مغلق يحدث ما يلي:
- تبدأ جزيئات السائل بالتبخر بمعدل ثابت.
- نتيجة تصادم جزيئات البخار مع بعضها وبجدار الوعاء تبدأ عملية تكاثف البخار تدريجياً، إلى أن يصبح عدد الجزيئات المتكاثفة = عدد الجزيئات المتبخرة، أو معدل سرعة التبخر = معدل سرعة التكاثف، ويصل السائل إلى حالة الاتزان.
- يسمى ضغط البخار على سطح السائل عند الوصول إلى حالة الاتزان عند درجة حرارية معينة بالضغط البخاري للسائل.
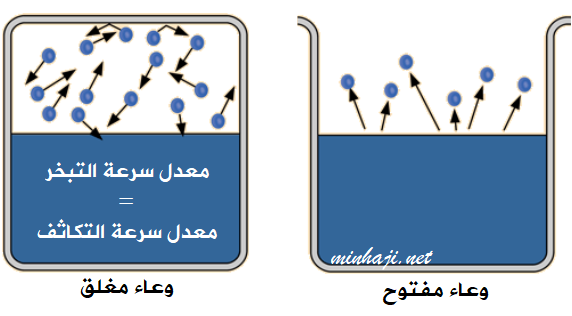
الضغط البخاري: ضغط بخار السائل في حالة الاتزان عند درجة حرارة معينة.
ويمكن ملاحظة ذلك من الرسم البياني التالي:
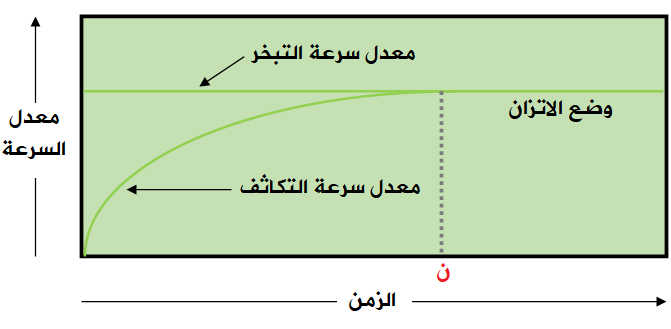
لاحظ من الشكل أن سرعة التبخر تبقى ثابته مع مرور الزمن، بينما تزداد سرعة التكاثف مع مرور الزمن إلى أن نصل إلى الزمن (ن) الذي يتساوى فيه معدل سرعة التبخر ومعدل سرعة التكاثف، وعند هذا الزمن يقاس الضغط البخاري.
العوامل المؤثرة في الضغط البخاري
- درجة الحرارة: بزيادة درجة الحرارة تزداد عدد الجزيئات التي تمتلك الطاقة الضرورية للتبخر فتزداد سرعة التبخر وسرعة التكاثف مما يؤدي إلى زيادة الضغط البخاري.
- قوى التجاذب بين جزيئات السائل: بزيادة قوى التجاذب بين جزيئات السائل، يقل عدد الجزيئات المتبخرة وتقل سرعة التبخر وسرعة التكاثف، مما يؤدي إلى نقصان الضغط البخاري.

ولدراسة أثر درجة الحرارة وقوى التجاذب في الضغط البخاري انظر إلى المنحنى الآتي والذي يمثل قيم الضغط البخاري لكل من الماء H2O وثلاثي كلوروميثان CHCl3 وثنائي إيثيل إيثر (C2H5)2O عند درجات حرارية مختلفة:
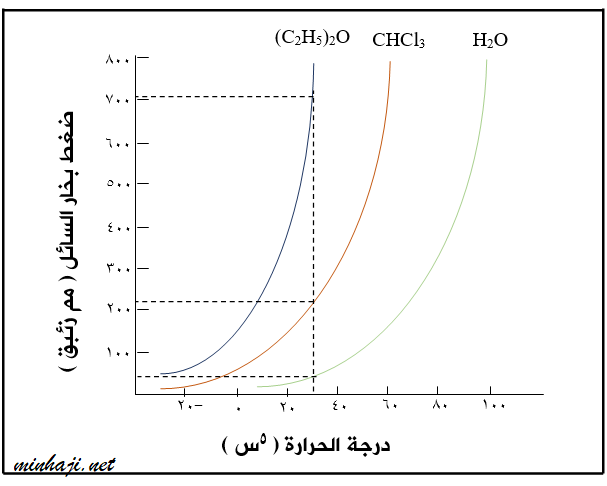
- لمعرفة قيمة الضغط البخاري للسوائل الثلاث عند 300C مثلا ً نرسم خطا ً مستقيما ً يمتد عموديا ً من درجة 300C بحيث يتقاطع مع المنحنيات الثلاثة ثم نقرأ قيم الضغط البخاري المقابلة.
- لاحظ أن الماء (روابط هيدروجينية) يمتلك أقل قيمة للضغط البخاري مقارنة مع السائلين الآخرين (العلاقة عكسية بين قوى التجاذب والضغط البخاري).
- لو اخترنا درجة حرارية أخرى نلاحظ أن زيادة درجة الحرارة تؤدي إلى زيادة الضغط البخاري للسائل (العلاقة طردية بين درجة الحرارة والضغط البخاري للسائل).
سؤال (1):
فسر سبب كون الضغط البخاري للمركب HF أقل من الضغط البخاري للمركب SiCl4
الجزيء HF قطبي، وتترابط جزيئاته بروابط هيدروجينية، وجزيء SiCl4 غير قطبي، وتترابط جزيئاته بقوى لندن، وبما أن قوى التجاذب بين جزيئات HF (روابط هيدروجينية) أقوى من قوى لندن الموجودة بين جزيئات SiCl4 ، لذا فإن الضغط البخاري يقل (العلاقة عكسية بين قوى التجاذب والضغط البخاري).
سؤال (2):
أي المادتين: CH3OCH3 أم CH3CH2OH لها ضغط بخار سائل أقل عند الظروف نفسها؟ فسر ذلك.
CH3CH2OH
كلاهما قطبيان، إلا أن جزيئات CH3CH2OH تترابط فيما بينها بروابط هيدروجينية أقوى من قوى ثنائية القطب الموجودة بين جزيئات CH3OCH3 ، وبزيادة قوى التجاذب يقل الضغط البخاري (العلاقة عكسية بين قوى التجاذب والضغط البخاري).
سؤال (3):
رتب الجزيئات الآتية حسب زيادة ضغط بخار السائل لها عند درجة الحرارة نفسها:
الإيثانول CH3CH2OH ، الإيثان CH3CH3 ، فلوروإيثان CH3CH2F ، الميثانول CH3OH .
إيثان > فلوروإيثان > ميثانول > إيثانول
سؤال (4):
أي جزيء من الجزيئات الآتية له أعلى ضغط بخار سائل عند درجة الحرارة نفسها:
CH3CH2OH ، CH3CH2CH3 ، CH3CH2Cl ، HOCH2CH2OH .
CH3CH2CH3
سؤال (5):
رتب المركبات الآتية ( HI , HBr , HCl , HF ) تنازلياً حسب تناقص ضغطها البخاري وهي في الحالة السائلة.
( العدد الذري لـ H = 1 ، F = 9 ، Cl = 17 ، Br = 35 ، I = 53 )
HCl > HBr > HI > HF
أفكر صفحة (85):
أفسر تزايد الضغط البخاري للسائل بزيادة درجة حرارته.
يزداد الضغط البخاري بزيادة درجة الحرارة وذلك لزيادة عدد الجزيئات التي تمتلك الحد الأدنى من الطاقة اللازمة للتبخر فتزداد سرعة التبخر ويزداد عدد الجزيئات المتبخرة والمؤثرة في وحدة المساحة من سطح السائل فيزداد الضغط البخاري.
أرتب السوائل الآتية حسب تزايد ضغطها البخاري عند درجة الحرارة نفسها:
CH3F ، CH3OH ، CH3CH3
CH3CH3 > CH3F > CH3OH
أتحقق صفحة (85):
مستعيناً بالشكل (18)، أحدد الضغط البخاري لكل من ثلاثي كلوروميثان والماء عند درجة 500C ، وأقارنها بقيمة ضغطه البخاري الواردة في الجدول (2). ماذا أستنتج؟
الضغط البخاري لثلاثي كلوروميثان: 500 mmHg
الضغط البخاري للماء: 100 mmHg
عند مقارنة الضغط البخاري لكلا المادتين عند 500 و 200 ألاحظ أنه كلما زادت درجة الحرارة زاد الضغط البخاري للسائل.
إعداد : أ. أحمد الحسين
12 / 11 / 2021
النقاشات