إجابات أسئلة مراجعة الوحدة
السؤال الأول:
الفكرة الرئيسة: ما المقصود بكلّ من:
التصادمات المرنة، قانون أفوجادرو، المائع، المادة الصلبة الجزيئية.
التصادمات المرنة: تصادمات بين جسيمات يبقى مجموع الطاقة الحركية خلالها محفوظاً.
قانون أفوجادرو: الحجوم المتساوية من غازات تحتوي على عدد الجسيمات نفسه عند الظروف نفسها من الضغط ودرجة الحرارة.
المائع: المواد التي تمتلك جسيماتها القدرة على الانسياب أو الجريان.
المادة الصلبة الجزيئية: المادة الصلبة التي تتكون جسيماتها من جزيئات.
السؤال الثاني:
أفسّر ما يأتي:
- يتناسب ضغط الغاز طردياً مع درجة حرارته عند ثبات حجمه.
لأن زيادة درجة حرارة الغاز تزيد من متوسط الطاقة الحركية لجسيماته فتزداد سرعتها وتزداد عدد تصادماتها مع جدار الإناء الذي توجد فيه، فيزداد ضغط الغاز.
- انتشار غاز NH3 أسرع من انتشار غاز CO2 .
لأن الكتلة المولية لغاز (Mr = 17g/mol) NH3 أقل من الكتلة المولية للغاز (Mr = 44g/mol) CO2 ، وكلما قلت الكتلة المولية للغاز زادت سرعة انتشاره.
- درجة انصهار CH3COOH أكبر من درجة انصهار C2H5Cl .
لأن جزيئاته تترابط بروابط هيدروجينية قوية نسبياً مقارنة مع قوى ثنائية القطب التي تربط جزيئات C2H5Cl فتحتاج لطاقة أكبر لكسرها؛ ما يفسر ارتفاع درجة انصهارها.
السؤال الثالث:
أحسب كتلة غاز O2 الموجودة في وعاء حجمه 5 L عند درجة حرارة 20 0C وضغط 1.5 atm .
T = 20 + 273 = 293 K
PV = n RT
1.5 x 5 = n x 0.082 x 293
n = 0.31 mol
n = m / Mr
m = 0.31 x 32 = 9.92 g
السؤال الرابع:
أحسب كثافة غاز SO2 عند درجة حرارة 35 0C وضغط 0.97 atm .
T = 35 + 273 = 308 K , Mr SO2 = 64 g/mol
d = Mr x p / (RT)
d = 64 x 0.97 / (0.082 x 308)
d = 2.458 g/L
السؤال الخامس:
يحتوي وعاء حجمه 1.64 L على (1.1 g CO2) و (1.6 g O2) وكتلة مجهولة من N2 . إذا علمت أن الضغط الكلي للغازات الثلاثة يساوي 1.5 atm عند درجة 270C ، فاحسب:
- الضغط الجزئي لكل من الغازات CO2 ، O2 ، N2 .
T = 27 + 273 = 300 K
n = m / Mr
n CO2 = 1.1 / 44 = 0.025 mol
n O2 = 1.6 / 32 = 0.05 mol
PV = n RT
P CO2 x 1.63 = 0.025 x 0.082 x 300
P CO2 = 0.375 atm
P O2 x 1.63 = 0.05 x 0.082 x 300
P O2 = 0.75 atm
P CO2 + P O2 = 1.125 atm
P N2 – PT – (P CO2 + P O2)
P N2 = 0.375 atm
- كتلة غاز N2 في الوعاء.
بما أن الضغط الجزئي لـ CO2 يساوي الضغط الجزئي لـ N2 = 0.375 atm فإن عدد مولات CO2 يساوي عدد مولات N2 عند الظروف نفسها = 0.025 mol ، ومنه نحسب كتلة N2
m N2 = 0.025 x 28 = 0.7 g
السؤال السادس:
أدرس الجدول الآتي، الذي يبين الضغط البخاري لثلاثة سوائل A , B , C عند درجة حرارة معينة، ثم أجيب عن الأسئلة الآتية:
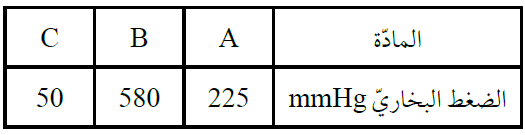
- ما المادة الأسرع تبخراً؟
B
- ما المادة التي لها أعلى درجة غليان عادية؟
C
- أرتب السوائل الثلاثة حسب تزايد قوى التجاذب بين جزيئاتها.
B < A < C
السؤال السابع:
إذا كانت طاقة التبخر المولية للسوائل الآتية، كما هو موضح:
O2 (6.8 KJ/mol) , Ne (1.8 KJ/mol) , CH3OH (34.5 KJ/mol),
فهل تتفق هذه القيم مع توقعاتك؟ فسر إجابتك.
نعم تتفق؛ وذلك لأن قوى التجاذب بين جزيئات CH3OH هي رابطة هيدروجينية قوية نسبياً مقارنة بقوى لندن التي تربط جزيئات كل من O2 و Ne ، كما أن الكتلة المولية لـ O2 أكبر منها لـ Ne لذلك قوى التجاذب بين جزيئاته أكبر، وكلما كانت قوى التجاذب بين الجزيئات أقوى زادت طاقة التبخر المولية.
السؤال الثامن:
أحدد المادة التي لها أعلى درجة انصهار بين الأزواج الآتية:
- LiF , Li2O
- SiO2 , CO2
- Na , Al
السؤال التاسع:
إذا علمت أن كثافة الماس 3.5 g/mL ، وأن كثافة الغرافيت 2.3 g/mL . اعتماداً على التركيب البلوري لبكمنسترفولرين، هل تتوقع أن تكون كثافته أكبر أم أقل منهما؟ برّر إجابتك.
أقل؛ لأنه يتكون من جزيئات C60 تكون على شكل كرات مجوفة تترابط مع بعضها بقوى لندن، أما الماس والغرافيت فكلاهما مادة صلبة شبكية تساهمية تترابط ذراتها بروابط تساهمية في بناء شبكي صلب. المتوقع أن الحجم الذي يشغله أي عدد من المولات من بكمنسترفوليرين أكبر منه بالنسبة لعدد المولات نفسه من الماس أو الغرافيت، وبالتالي فإن كثافته المتوقعة أقل.
السؤال العاشر:
أختار الإجابة الصحيحة لكل فقرة من الفقرات الآتية:
1- إحدى العبارات الآتية لا تتفق مع نظرية الحركة الجزيئية:
أ- حركة جزيئات الغاز مستمرة وعشوائية.
ب- متوسط الطاقة الحركية للغازات ثابت عند درجة الحرارة نفسها.
ج- تتصادم جزيئات الغاز تصادمات مرنة.
د- تتحرك جميع جزيئات الغاز بالسرعة نفسها عند درجة الحرارة نفسها.
2- إذا علمت أن الكتلة المولية للغازات الآتية
(H2 = 2g/mol , N2 = 28g/mol , O2 = 32g/mol , Ne = 20g/mol)
فإن أقل هذه الغازات انحرافاً عن سلوك الغاز المثالي عند الظروف نفسها، هو:
أ- H2
ب- N2
ج- O2
د- Ne
3- عينة من الغاز المحصور حجمها (V) عند درجة حرارة (350C)، فإن درجة الحرارة التي يتضاعف عندها حجم الغاز (2V) عند ثبات الضغط، هي:
أ- 350C
ب- 700C
ج- 3080C
د- 3430C
4- عند مضاعفة درجة الحرارة (كلفن) لعينة من غاز محصور 3 مرات ومضاعفة حجمه مرتين، فإن ضغطه الجديد يساوي:
أ- 1/6 من الضغط الأصلي.
ب- 2/3 من الضغط الأصلي.
ج- 3/2 من الضغط الأصلي.
د- 5 أضعاف الضغط الأصلي.
5- إحدى الرسوم البيانية الآتية توضح العلاقة بين حجم الغاز ودرجة حرارته المطلقة عند ثبات ضغطه:
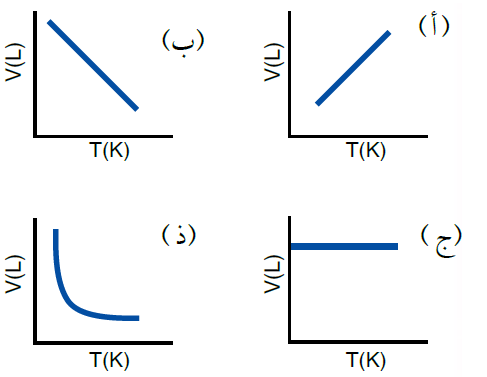
أ-
6- المادة التي لها أعلى درجة غليان عادية، هي:
أ- CH3CH3
ب- CH3CH2CH3
ج- CH3CH2OH
د- CH3OCH3
7- ترتيب السوائل الآتية: CH4 , CHBr3 , CH3Cl حسب تناقص طاقة تبخرها المولية:
أ- CHBr3 < CH4 < CH3Cl
ب- CHBr3 < CH3Cl < CH4
ج- CH3Cl < CHBr3 < CH4
د- CH4 < CH3Cl < CHBr3
8- أحد العوامل الآتية لا يؤثر في الضغط البخاري للسائل:
أ- حجم السائل.
ب- شكل الإناء.
ج- درجة الحرارة.
د- الإجابتان أ+ب
9- إذا علمت أن عنصر البورون صلب للغاية، درجة انصهاره 23000C ، وهو ردىء التوصيل للكهرباء على درجة الحرارة العادية، فإن نوع المادة الصلبة البلورية التي يكونها:
أ- جزيئية.
ب- تساهمية شبكية.
ج- فلزية.
د- أيونية.
10- المادة الصلبة البلورية الموصلة للتيار الكهربائي في حالتي الصلابة والسيولة، هي:
أ- KF
ب- SiO2
ج- Cu
د- S8
إعداد : شبكة منهاجي التعليمية
23 / 11 / 2021
النقاشات