الرابطة التناسقية
Coordinate Bond
تنشأ الرابطة التناسقية بين ذرتين، تشارك إحداهما بزوجٍ غير رابطٍ من الإلكترونات، بينما تشارك الأخرى بفلكٍ فارغ.
لا تختلف الرابطة التناسقية في صفاتها عن الرابطة التساهمية، ففي كلا الحالتين تتشارك الذرتان بزوجٍ من الإلكترونات.
مثال (1):
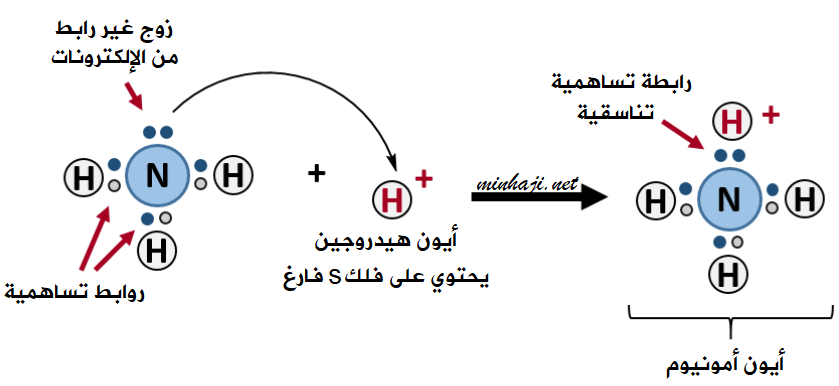
تنشأ رابطة تناسقية بين الأمونيا وأيون الهيدروجين، عند تفاعل محلول الأمونيا مع محلول حمض الهيدروكلوريك:
NH3 (aq) + HCl (aq) → NH4+ + Cl- (aq)
يمكن لذرة النيتروجين في جزيء الأمونيا NH3 أن تقدم زوجاً غير رابط من الإلكترونات إلى الفلك الفارغ في أيون الهيدروجين الموجب، فتتكون رابطة تناسقية بين النتروجين وأيون الهيدروجين، ويتكون أيون الأمونيوم NH4+ .
مثال (2):
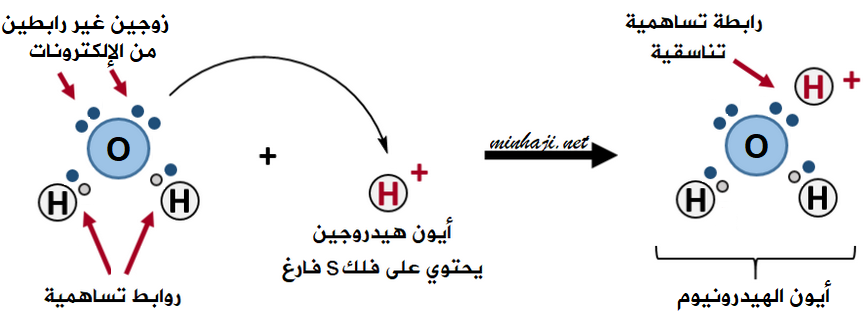
تتكون رابطة تناسقية بين الماء H2O وأيون الهيدروجين H+ لتكوين أيون الهيدرونيوم H3O+.
تحتوي ذرة الأكسجين في الماء على زوجين غير رابطين من الإلكترونات.
تقدم ذرة الأكسجين في جزيء الماء زوجاً غير رابط من الإلكترونات إلى الفلك الفارغ في أيون الهيدروجين، فتتكون بينهما رابطة تناسقية، ويتكوّن أيون يسمى أيون الهيدرونيوم H3O+ .
مثال (3):
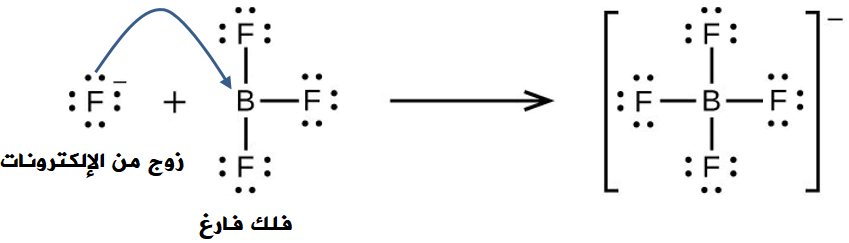
تتكون رابطة تناسقية عند تفاعل فوريد البورون (BF3) مع حمض الهيدروفلوريك (HF) مكوناً الأيون (BF4-)، كما في المعادلة:
BF3 + HF → BF4- + H+
وتنشأ الرابطة التناسقية عندما يقدم أيون الفلوريد (F-) زوجاً غير رابط من الإلكترونات، وتقدم ذرة البورون فلكاً فارغاً.
إعداد : أ. أحمد الحسين
16 / 09 / 2022
النقاشات