أسئلة الوحدة
السؤال الأول:
وضح المقصود بكلّ من المصطلحات الآتية:
الماء النقي، الماء غير النقي، تلوث الماء، الماء الصالح للشرب، الذائبية، التبلور.
السؤال الثاني:
فسّر كلاً ممّا يلي:
أ- يؤدي التلوث الحراري (ارتفاع درجة حرارة المياه) إلى موت العديد من الكائنات التي تعيش في البحيرات.
ب- رغم أن مياه الأمطار تأتي من البحار والمحيطات ذات المياه المالحة، إلا أنها صالحة للشرب.
ج- يعتبر الكثيرون أن النشاط الإنساني هو المسؤول الأول عن التلوث المائي.
السؤال الثالث:
اشرح دورة الماء في الطبيعة، وبين دورها في زيادة نسبة الأملاح الذائبة في الماء.
السؤال الرابع:
ضع إشارة (✓) للعبارة الصحيحة، وإشارة (✗) للعبارة الخطأ في المكان المخصص لها فيما يلي:
أ- ( ) يحصل كل شخصٍ على سطح الأرض على الكميّة الكافية من المياه العذبة.
ب- ( ) يُعد الماء ملوثاً إذا زادت نسبة أحد العناصر فيه عن الحد المسموح به.
ج- ( ) آلية معالجة الماء واحدة في جميع محطات المعالجة.
د- ( ) يُعد التلوثُ سبباً من أسباب نقص كميّات المياه العذبة.
هـ- ( ) يُعد الأردن من الدول التي تعاني من الفقر المائي.
السؤال الخامس:
ضع دائرة حول رمز الإجابة الصحيحة لكلٍّ مما يأتي:
- العبارة الصحيحة فيما يتعلق بعملية التبلور، هي:
أ- يتم استخلاص الأملاح الذائبة في الماء عن طريق التبلور.
ب- التبلور عملية تهدف إلى الحصول على الماء النقي.
ج- لإجراء عملية التبلور يجب تحضير محلولٍ مشبعٍ عند درجة حرارةٍ عاليةٍ، ثم تبريده.
د- تُستخدم عملية التبلور في فصل الأملاح الذائبة في الماء بعضها عن بعضٍ تبعاً لاختلاف درجة الحرارة.
- طريقة تنقية المياه التي لا تعتمد على تغير درجة الحرارة، هي:
أ- التجميد.
ب- التقطير.
ج- الأسموزية المعاكسة.
د- التبلور.
- المادة الأكثر فاعلية في إزالة الطعم واللون غير المرغوبين من بين المواد التالية، هي:
أ- الأوزون.
ب- الفلور.
ج- الكربون المنشط.
د- الكلور.
- أول الأملاح التي يتم ترسيبها من أملاح البحر الميت هي أملاح:
أ- الصوديوم.
ب- البوتاسيوم.
ج- المغنيسيوم.
د- الكالسيوم.
- العبارة الصحيحة التي توضح أثر درجة الحرارة في الذائبية، هي:
أ- تقل الذائبية بشكلٍ عام بارتفاع درجة الحرارة، وتزداد بانخفاض درجة الحرارة.
ب- تزداد ذائبية الغازات وتقل ذائبية معظم المواد الصلبة بارتفاع درجة الحرارة.
ج- تقل ذائبية الغازات وتزداد ذائبية معظم المواد الصلبة بارتفاع درجة الحرارة.
د- لا يؤثر تغيّر درجة الحرارة في ذائبية الغازات والمواد الصلبة.
- عند خلط كمية من كلوريد الأمونيوم NH4Cl مع كمية من هيدروكسيد الصوديوم NaOH في جفنة وإضافة بعضٍ من قطرات الماء يتصاعد غاز ذو رائحةٍ نفاذةٍ هو غاز:
أ- الهيدروجين.
ب- الأمونيا.
ج- ثاني أكسيد الكربون.
د- الأكسجين.
السؤال السادس:
قارن بين طريقتي التقطير والأسموزية المعاكسة في تنقية المياه من حيث:
أ- المبدأ الذي تقوم عليه كل طريقةٍ.
ب- تغير حالة الماء أثناء عملية التنقية.
السؤال السابع:
أرادت ربَّة منزلٍ تنظيف أواني الطبخ بعد استخدامها؛ فأحضرت الأواني ووضعتها في حوض المجلى، ثم فتحت صنبور الماء عليها لتخليصها من بقايا الطعام، وأحضرت وعاءً وضعت فيه منظف الأواني وملأته بالماء وغمست فيه الإسفنجة الخاصة بالتنظيف، وبدأت بتنظيف الأواني باستخدام الإسفنجة، وكانت كلما نظفت أحد الأواني غسلته من المنظف تحت صنبور الماء ووضعته جانباً، حتى انتهت عملية التنظيف.
أ- برأيك، ما الأخطاء التي ارتكبتها ربة المنزل أثناء عملية التنظيف؟
ب- قدم بعض النصائح لربّة المنزل تساعد في ترشيد استهلاك الماء.
السؤال الثامن:
إذا كان لديك محلول مائي مشبع من كبريتات النحاس CuSO4 ، فما الذي تجريه للحصول على:
أ- أكبر كمية من بلورات كبريتات النحاس النقية.
ب- جميع كمية كبريتات النحاس المذابة.
السؤال التاسع:
لديك الرسم البياني التالي الذي يمثل تغير ذائبية نترات البوتاسيوم في الماء بتغير درجة الحرارة. استخدم الرسم في الإجابة عن الأسئلة التي تليه:
.jpg)
أ- ما كتلة نترات البوتاسيوم اللازمة لتحضير محلولٍ مشبعٍ منه في 100 غ من الماء عند درجة حرارة 50هس؟
ب- عند أي درجة حرارة تكون ذائبية نترات البوتاسيوم 150 غ/ 100 غ ماء؟
ج- ما كتلة نترات البوتاسيوم اللازمة لإشباع 250 غ من الماء عند حرارة 65 هس؟
د- إذا بّرّدَ المحلول في الفرع السابق إلى درجة حرارة 20 هس، فما كتلة المادة المترسبة؟
السؤال العاشر:
تم تحضير محلول مائي مشبع لملحٍ مجهول في 200 غ من الماء عند درجة حرارة 70هس، ثم جرى تبريد المحلول إلى درجة 40هس، فماذا تتوقع أن يحدث؟ احسب كتلة المادة المترسبة؟ علماً بأن ذائبية الملح في الماء تساوي (30 غ/ 100 غ ماء) عند درجة حرارة 40هس، وتساوي (65 غ/ 100 غ ماء) عند درجة 70هس.
السؤال الحادي عشر:
أكمل المعادلات التالية التي تمثل تفكك عددٍ من المواد الأيونية في الماء.
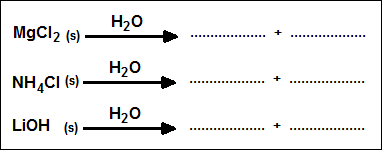
السؤال الثاني عشر:
يبين الشكل أثر زيادة تركيز أيون الزئبق في الأسماك في إحدى البحيرات.
أ- صف ما تشاهده في الشكل.
ب- لماذا تسبب زيادة تركيز أيون الزئبق في الماء هذه الظاهرة؟
ج- اذكر أسماء بعض الأيونات الأخرى التي قد تُحدِث تأثيراً مُشابهاً لما يظهر في الشكل.
د- ما سبب زيادة تركيز أيون الزئبق في البحيرات من وجهة نظرك؟
هـ- اقترح طرائق تُسهم في الحدِّ من حدوث هذه الظاهرة.

السؤال الثالث عشر:
أكمل الفراغ في كلٍّ من العبارات الآتية:
أ- تركيز محلول حجمه 180 مل حُضر بإذابة 12 غ من السكر في الماء يساوي ........
ب- صيغة الأيون الموجب الذي ينتج من تفكك المركب (FeCl3)، هي ........
ج- يمكن أن يحدث تبلورٌ للمادة الزائدة عن الإشباع في محلولٍ ما إذا ........ أو ........
د- عملية تبخير الماء ثم تكثيفه للحصول على ماءٍ نقيٍّ تُسمى ........
هـ- المادة الهلامية التي تساعد في عملية التلبد في أثناء معالجة الماء في محطات التنقية هي ........
السؤال الرابع عشر:
أجب عمّا يلي:
أ- محلولان، حُضر الأول منهما بإذابة 2 غ من كلوريد البوتاسيوم KCl في 8 غ ماء، وحضر الثاني بإذابة 12 غ من نترات الفضة AgNO3 في 87 غ ماء. فإذا علمت أن كثافة المحلول الأول 1,25 غ/مل، وأن كثافة المحلول الثاني تساوي 1,1 غ/مل، املأ الفراغات في الجدول الآتي بالبيانات المناسبة.
|
الرقم |
اسم المحلول |
صيغ الأيونات الموجودة فيه |
كتلة المذاب (غ) |
كتلة المذيب (غ) |
حجم المحلول (مل) |
تركيز المحلول (غ/مل) |
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
ب- عند خلط المحلولين معاً تكوَّنَ راسبٌ أبيضُ، اكتب معادلة كيميائية أيونية تُمثّل التفاعل الحاصل بين المحلولين. وما الصيغة الكيميائية للراسب.
السؤال الخامس عشر:
قام طالب بقياس ذائبية ملحٍ في الماء عند درجة 20هس، وفق الخطوات الآتية:
أ- حَضَّرَ محلولاً مشبعاً من الملح في الماء عند درجة حرارة 40هس.
ب- ترك المحلول إلى أن استقرَّ الراسبُ في قاع الكأس الزجاجية، ثم برَّدَهُ إلى درجة حرارة 20هس.
ج- صبَّ بعض المحلول بسرعةٍ في جفنةٍ جافةٍ ونظيفةٍ وموزونةٍ مُسبقاً، ثم وزنها من جديدٍ.
د- بخَّرَ الماءَ من الجفنةِ على نارٍ هادئةٍ، إلى أن جفَّت تماماً، ثم وزنها.
هـ- سجَّلَ ملاحظاته في الجدول الآتي:
|
كتلة الجفنة الجافة |
37,5 غ |
|
كتلة الجفنة + المحلول |
60,0 غ |
|
كتلة الجفنة + الراسب |
40,0 غ |
اعتماداً على المعلومات السابقة أجب عن الأسئلة الآتية:
- اقترح سبباً لضرورة تبخير المحول على نارٍ هادئةٍ.
- كيف تتأكد أن الماء في المحلول قد تبخَّرَ كلياً.
- احسب كتلة الماء المتبخر من الجفنة.
- احسب كتلة المادة الصلبة المتبقية بعد التبخير.
- احسب ذائبية الملح في الماء عند درجة حرارة 20هس بوحدة (غ مذاب/100 غ/ماء).
إعداد : شبكة منهاجي التعليمية
20 / 12 / 2018
النقاشات