رابعاً: تفاعلات الإحلال المزدوج
Double Displacement Reactions
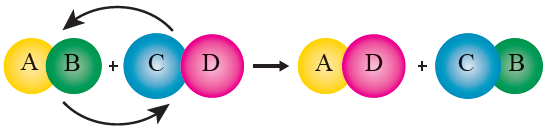
تفاعل الإحلال المزدوج: تفاعل كيميائي يحل فيه عنصران كل منهما محل الآخر في مركباتهما أو المحلول المائي لأملاحهما.
وبطريقة أخرى يمكن أن نقول أنه التفاعل الذي يحدث فيه تبادل بين موقعي الأيونين الموجبين (أو السالبين) في مركباتهما أو أملاحهما.
الصيغة العامة لتفاعل الإحلال المزدوج:
AB + CD → AD + CB
تقسم تفاعلات الإحلال المزدوج إلى ثلاثة أقسام، هي:
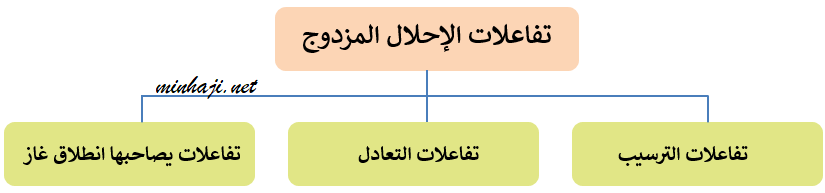
(1) تفاعل الترسيب
تفاعل الترسيب: تفاعل تظهر فيه مادة راسبة نتيجة خلط محلولين لملحين ذائبين.
أمثلة:
- تترسب كربونات النحاس عند خلط محلول كربونات الصوديوم مع محلول كبريتات النحاس:
Na2CO3 (aq) + CuSO4 (aq) → Na2SO4 (aq) + CuCO3 (s)
- يترسب كلوريد الفضة عند مزج محلولي نترات الفضة وكلوريد الصوديوم:
AgNO3 (aq) + NaCl (aq) → AgCl (s) + NaNO3 (aq)
(2) تفاعل التعادل
تفاعل التعادل: تفاعل يحدث بين محاليل الحموض والقواعد القوية؛ وينتج عنه ملح وماء.
في تفاعل التعادل تتعادل الأيونات +H الناتجة من تأين الحمض مع الأيونات -OH الناتجة من تأين القاعدة لإنتاج الماء.
أمثلة:
- تفاعل التعادل بين محلول حمض الهيدروكلوريك ومحلول هيدروكسيد الصوديوم:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l)
- تفاعل التعادل بين محلول حمض الكبريتيك ومحلول هيدروكسيد الليثيوم:
2LiOH (aq) + H2SO4 (aq) → Li2SO4 (aq) + 2H2O (l)
(3) تفاعلات يصاحبها انطلاق غاز
بعض تفاعلات الإحلال المزدوج ينتج عنها انطلق غاز.
أمثلة:
- تفاعل كبريتيد الحديد مع محلول حمض الهيدروكلوريك، وينطلق غاز كبريتيد الهيدروجين وفق المعادلة:
FeS (s) + 2HCl (aq) → FeCl2 (aq) + H2S (g)
- تفاعل محلول حمض الهيدروكلوريك مع محلول كربونات الكالسيوم وفق المعادلة:
CaCO3 (aq) + 2HCl (aq) → CaCl2 (aq) + H2O (l) + CO2 (g)
ويعد هذا التفاعل تفاعل إحلال مزدوج لأن أيون الكالسيوم في CaCO3 قد حل محل أيون الهيدروجين في الحمض HCl مكوناً ملح CaCl2 ، كما أن أيون الهيدروجين في الحمض قد حل محل الكالسيوم في كربونات الكالسيوم وكوّن حمض H2CO3 ، وهو حمض غير ثابت، يتفكك إلى ماء وغاز ثاني أكسيد الكربون.
إعداد : أ. أحمد الحسين
12 / 02 / 2022
النقاشات