النموذج النووي للذرة
فرضت تجربة رذرفورد عليه أن يرفض نموذج طومسون، وأن يقترح بديلاً عنه.
فسّر رذرفورد نتيجة تجربته على النحو التالي:
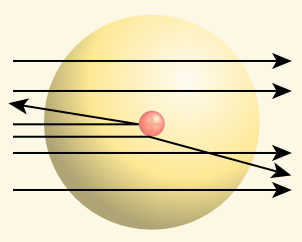
- اختراق معظم جسيمات ألفا صفيحة الذهب بسبب الفراغ الكبير الموجود في الذرة، واقترح أن تنتشر الإلكترونات في ذلك الفراغ.
- ارتداد بعض جسيمات ألفا نتيجة اصطدامها مباشرة بجسم كثافته عالية، وحجمه صغير أطلق عليه اسم النواة، وتتركز فيه الشحنات الموجبة (البروتونات) ويشكل معظم كتلة الذرة.
- انحراف بعض جسيمات ألفا يعود لاقترابها من النواة موجبة الشحنة فتتنافر معها.
النيوترون
عندما وضع رذرفورد نموذجه للذرة، كان معلوماً أن الذرة تحتوي على إلكترونات عديمة الكتلة تقريباً، ونواة تتركز فيها البروتونات.
وعند قياس كتل الذرات لوحظ أن كتل معظم الذرات يساوي ضعف كتلة بروتوناتها تقريباً، فمن أين جاء ذلك الفرق في الكتلة؟
افترض العلماء وجود جسيمات لها كتلة مساوية لكتلة البروتونات، ولكنها متعادلة كهربائياً، وأطلق عليها اسم النيوترون.
ولأن النيوترون عديم الشحنة، ولا يتأثر بالمجال المغناطيسي، ولا يكوّن ضوءاً على شاشة الفلورسنت، فقد تأخر اكتشافه حتى تمكن العلماء من إثبات وجوده.
إعداد : شبكة منهاجي التعليمية
09 / 08 / 2022
النقاشات