
الحموض الكربوكسيلية: مركبات عضوية غير مشبعة تحتوي على مجموعة كربوكسيل (COOH) كمجموعة وظيفية، وتحمل الصيغة العامة:
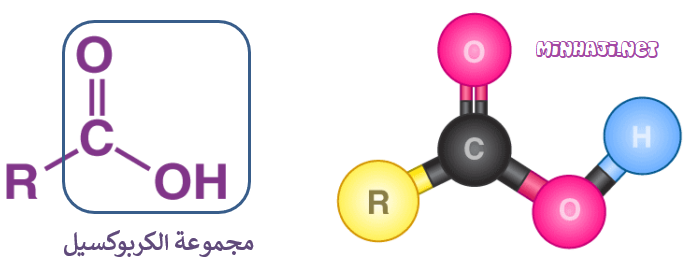
(يمكن أن تكون R ذرة هيدروجين).
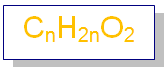
تحمل الحموض الكربوكسيلية الصيغة الجزيئية العامة:
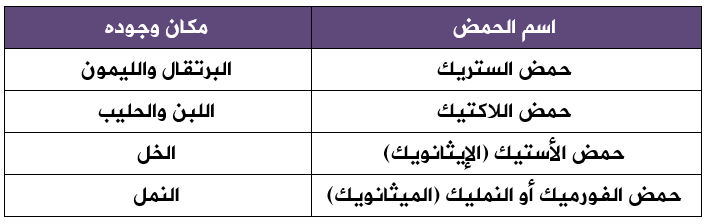
توجد الحموض الكربوكسيلية في العديد من المواد مثل:
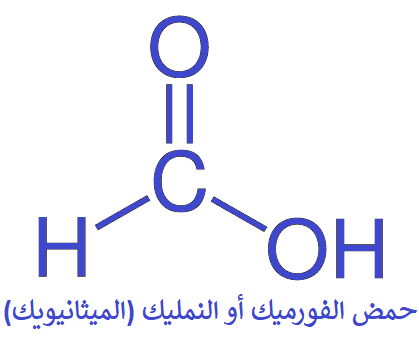
أبسط الحموض الكربوكسيلية يتكون من ذرة كربون واحدة فقط، أي أن (R = H)، ويعرف هذه الحمض باسمه الشائع حمض الفورميك أو حمض النمليك، ويفرزه النمل، وهو الذي يسبب الألم إذا تعرضت للسعة نملة.
تسمية الحموض الكربوكسيلية:
- أكتب كلمة حمض.
- أحسب عدد ذرات الكربون في المركب ومن ضمنها ذرة كربون مجموعة الكربوكسيل.
- أسمي المركب على وزن الكانويك.
- إذا احتوى الحمض الكربوكسيلي على تفرع فيسمى أولاً وقبل كلمة حمض بعد ترقيم السلسلة الكربونية من ذرة كربون مجموعة الكربوكسيل.
ملاحظة:
لا يشار في تسمية الحموض الكربوكسيلية إلى موقع مجموعة الكربوكسيل؛ لأنها طرفية.
مثال (1):
أسمّي المركب العضوي الآتي وفق نظام الأيوباك:
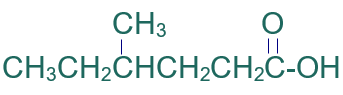
الخطوة الأولى: أكتب كلمة حمض.
الخطوة الثانية: أختار أطول سلسلة كربونية متتابعة.
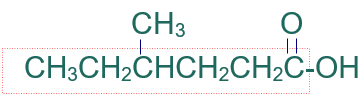
الخطوة الثالثة: أرقّم السلسلة من ذرة كربون مجموعة الكربوكسيل.
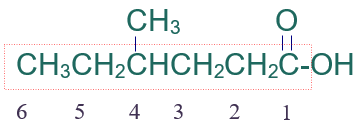
الخطوة الرابعة: أسمي التفرع (ميثيل) مسبوقاً برقم ذرة الكربون المرتبط به، ثم أسمي أطول سلسة على وزن الكانويك (هكسانويك).
فيصبح إسم المركب:
حمض 4- ميثيل الهكسانويك
مثال (2):
أسمّي المركب العضوي الآتي وفق نظام الأيوباك:
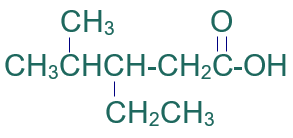
الخطوة الأولى: أكتب كلمة حمض.
الخطوة الثانية: أختار أطول سلسلة كربونية متتابعة.
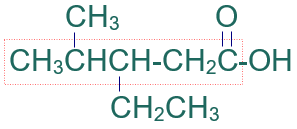
الخطوة الثالثة: أرقّم السلسلة من ذرة كربون مجموعة الكربوكسيل.
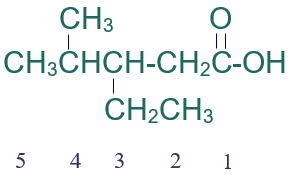
الخطوة الرابعة: أسمي التفرعات (إيثيل) ثم (ميثيل) مسبوقاً برقم ذرة الكربون المرتبط بها، ثم أسمي أطول سلسة على وزن الكانويك (بنتانويك).
فيصبح إسم المركب:
حمض 3- إيثيل -4- ميثيل بنتانويك
سؤال:
أكتب الصيغة البنائية للمركبين العضويين التاليين:
أ) حمض ميثيل بروبانويك.
ب) حمض 3- إيثيل – 5 – ميثيل هبتانويك.
الخصائص الفيزيائية للحموض الكربوكسيلية
أولاً : الترابط الهيدروجيني ودرجة الغليان
تترابط جزيئات الحموض الكربوكسيلية بروابط هيدروجينية، ويعزى سبب تكوين الحموض الكربوكسيلية لروابط هيدروجينية بين جزيئاتها إلى احتوائها على الرابطة القطبية (O-H) ، مما يؤدي إلى حدوث تجاذب بين ذرة الهيدروجين في جزيء حمض كربوكسيلي وذرة أكسجين في جزيء حمض كربوكسيلي آخر، وفي الواقع فإن تعدد الروابط الهيدروجينية في الحمض الكربوكسيلي يتسبب في زيادة قوى التجاذب بين جزيئاتها وبالتالي ارتفاع درجة غليانها، حتى أن درجة غليانها أعلى من الكحولات.
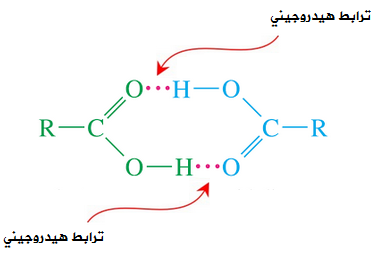
يعتمد الترابط الهيدروجيني على عاملين هما:
- عدد الروابط الهيدروجينية (طردي).
- الكتلة المولية (طردي).
ثانياً: الذائبية في الماء
الحموض الكربوكسيلية التي تحتوي على عدد قليل من ذرات الكربون تذوب في الماء بأية نسبة نظراً لقدرتها على تكوين روابط هيدروجينية مع الماء، وبزيادة عدد ذرات الكربون تقل الذائبية، نظراً لأن المركب يقترب من خواص الألكانات.
سؤال (3) :
أيهما أعلى درجة غليان:
- الميثانول أم حمض الميثانويك؟
- حمض الميثانويك أم حمض الإيثانويك؟
سؤال (4) :
رتب المركبات الآتية حسب درجة غليانها:
بروبانون، بروبان، حمض البروبانويك، 1- بروبانول، حمض البيوتانويك.
إعداد : أ. أحمد الحسين
11 / 06 / 2022
النقاشات