المولارية (التركيز المولاري)
Molarity
المولارية: عدد مولات المادة المذابة في لتر واحد من المحلول.
ويعبر عن المولارية بالعلاقة الرياضية:

وتقاس المولارية بوحدة (mol/L) أو (M) وتلفظ مولار.
مثال (1):
أحسب مولارية محلول حجمه 0.5 L يحتوي على 0.1 mol من المذاب.
تحليل السؤال (المعطيات)
حجم المحلول V = 0.5 L
عدد مولات المذاب n = 0.1 mol
الحل:
M =
M = = 0.2 mol/L or 0.2 M
مثال (2):
أحسب مولارية محلول هيدروكسيد البوتاسيوم KOH حضر بإذابة 5.6 g في 0.2 L من الماء. علماً أنّ الكتلة المولية (KOH) = 56 g/mol
تحليل السؤال (المعطيات)
حجم المحلول V = 0.2 L
كتلة المذاب m = 5.6 g
الكتلة المولية للمذاب Mr = 56 g/mol
الحل:
نحسب عدد مولات المذاب (n):
n = m / Mr = 5.6 / 56 = 0.1 mol
نحسب التركيز المولاري:
M = = 0.5 M
سؤال:
حُضر محلول بإذابة 20 g من هيدروكسيد الصوديوم NaOH في كمية من الماء للحصول على محلول حجمه 250 mL. احسب تركيز NaOH المولاري. علماً أنّ الكتلة المولية (NaOH) = 40 g/mol
الحل النهائي: 2 mol/L
أتحقق صفحة (123):
أحسب كتلة السكر C6H12O6 اللازمة لعمل محلول حجمه 2 L وتركيزه 0.04 M . علماً أنّ الكتلة المولية (C6H12O6) = 180 g/mol
تحليل السؤال (المعطيات)
حجم المحلول = 2 L
التركيز المولاري M = 0.04 M
الكتلة المولية للمذاب Mr = 180 g/mol
الحل:
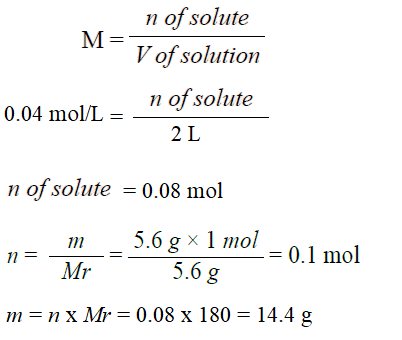
إعداد : أ. أحمد الحسين
25 / 02 / 2022
النقاشات