الرابطة المشتركة
Covalent bond
الرابطة المشتركة: هي اشتراك ذرتين بزوج من الإلكترونات أو أكثر.
تنشأ الرابطة المشتركة بين ذرتين لا تميلان لفقد الإلكترونات.
أنواع الروابط المشتركة
- الرابطة المشتركة الأحادية.
- الرابطة المشتركة الثنائية.
- الرابطة المشتركة الثلاثية.
أولاً: الرابطة المشتركة الأحادية
تنشأ عندما تتشارك الذرتين بزوج من الإلكترونات.
مثال:
جزي الهدروجين H2 .
من التوزيع الإلكتروني لذرة الهدروجين تلاحظ أنها تميل لكسب إلكترون ليصبح الغلاف السطحي لذرتها ممتلئاً.
1H: (1)
ولتحقيق ذلك تتشارك ذرتا هدروجين بزوج من الإلكترونات، وتنشأ بينهما رابطة مشتركة أحادية.

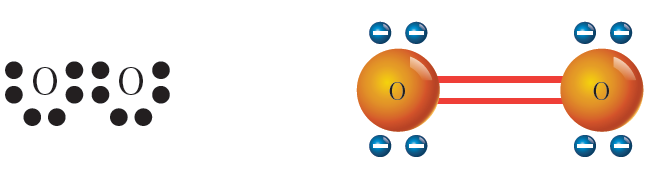
ثانياً: الرابطة المشتركة الثنائية
تنشأ عندما تتشارك الذرتين بزوجين من الإلكترونات (4 إلكترونات).
مثال:
جزي الأكسجين O2 .
من التوزيع الإلكتروني لذرة الأكسجين تلاحظ أنها تميل لكسب إلكترونين ليصبح الغلاف السطحي لذرتها ممتلئاً، وتحقق قاعدة الثمانية.
8O: (2-6)
ولتحقيق ذلك تتشارك ذرتا الأكسجين بزوجين من الإلكترونات، وتنشأ بينهما رابطة مشتركة ثنائية.
ثالثاً: الرابطة المشتركة الثلاثية
تنشأ عندما تتشارك الذرتين بثلاثة أزواج من الإلكترونات (6 إلكترونات).
مثال:
جزي الآزوت N2 .
من التوزيع الإلكتروني لذرة الآزوت تلاحظ أنها تميل لكسب 3 إلكترونات ليصبح الغلاف السطحي لذرتها ممتلئاً، وتحقق قاعدة الثمانية.
7N: (2-5)
ولتحقيق ذلك تتشارك ذرتا الآزوت بثلاثة أزواج من الإلكترونات، وتنشأ بينهما رابطة مشتركة ثلاثية.

خصائص المواد ذات الروابط المشتركة
- معظمها غازات.
- غير ناقلة للتيار الكهربائي.
- درجات غليانها منخفضة.

الإجابات:
غاز النشادر: ثلاث روابط مشتركة أحادية.
الماء: رابطتان مشتركتان أحاديتان.
غاز الميتان: أربع روابط مشتركة أحادية.
أكسيد الكالسيوم: رابطة أيونية.
كلوريد الألمنيوم: رابطة أيونية.
إعداد : شبكة منهاجي التعليمية
14 / 06 / 2019
النقاشات