إجابات أسئلة مراجعة الوحدة الأولى
بنية الذرة وتركيبها
السؤال الأول:
أوضح: المقصود بالمفاهيم والمصطلحات الآتية:
الطيف الكهرمغناطيسي، طيف الانبعاث الخطي، الطيف المتصل، الفوتون.
الطيف الكهرمغناطيسي: جميع الأطوال الموجية التي يتكون منها الضوء.
طيف الانبعاث الخطي: مجموعة من الأطوال الموجية للضوء الصادر عن ذرات العنصر المثارة عند عودة الإلكترون إلى حالة الاستقرار.
الطيف المتصل: مجموعة الأطوال الموجية التي تظهر في صورة مجموعة من الألوان المتتابعة المتداخلة (قوس المطر) التي يتكون منها الضوء العادي.
الفوتون: جسيمات مادية متناهية في الصغر تُمثّل الوحدات الأساسية المكونة للضوء، ويحمل كل منها مقداراً مُحدداً من الطاقة. وهي تعبر عن الطبيعة المزدوجة (مادية-موجية) للضوء.
السؤال الثاني:
أفسّر: لماذا يحتوي طيف الانبعاث الخطي على كميّات محددة من الطاقة بحسب نموذج بور؟
لأنه عند إثارة ذرة الهيدروجين، فإنها سرعان ما تعود إلى حالة الاستقرار، وتفقد الطاقة بكميات محددة، بناءً على فرق الطاقة بين المستويين الذي انتقل بينهما.
السؤال الثالث:
يمثل الشكل المجاور رسماً تخطيطاً لعددٍ من خطوط الطيف الصادرة عن ذرة هيدروجين مثارة. أدرس الشكل، ثم أجيب عن الأسئلة الآتية:
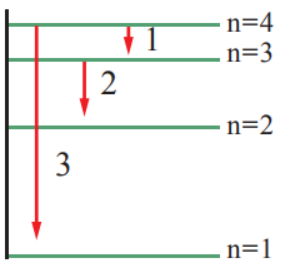
أ- أجد طاقة الإشعاع التي يمثلها الرقم (2).
n1 = 2 , n2 = 3
ΔE = RH ( – )
ΔE = 2.18 x 10-18 ( – )
ΔE = 2.18 x 10-18 ( – )
ΔE = 2.18 x 10-18 ( – ) = 2.18 x 10-18 x () = 3 x 10-19 J
ب- أتنبأ إذا كان طيف الإشعاع الذي يمثله الرقم (3) يظهر في منطقة الضوء المرئي أم لا.
يظهر في المنطقة غير المرئية، لأنه سقط على المستوى الأول، ولا يظهر الخط في المنطقة المرئية إلا إذا سقط على المستوى الثاني. ويمكن التحقق من الإجابة بحساب فرق الطاقة الناتج عن عودة الإلكترون من المستوى الرابع للمستوى الأول، ثم حساب التردد والطول الموجي، وتحويل الطول الموجي إلى نانومتر.
n1 = 1 , n2 = 4
ΔE = RH ( – )
ΔE = 2.18 x 10-18 ( – )
ΔE = 2.18 x 10-18 ( – )
ΔE = 2.18 x 10-18 () = 2.04 x 10-18 J
ΔE = h . v
2.04 x 10-18 = 6.63 x 10-34 . v
v = 0.3 x 1016 Hz
C = . v
3 x 108 = x 0.3 x 1016
= 0.3 x 10-8 m
وبتحويل طول الموجة إلى وحدة نانومتر بالضرب في 109، يتبين أن طول الموجة هو 3nm، وأنه يقع خارج منطقة الضوء المرئي.
ج- أستنتج عدد خطوط الطيف جميعاً عند عودة الذرة إلى حالة الاستقرار.
(6) خطوط.
السؤال الرابع:
أجد طاقة الإشعاع الصادرة عن ذرة الهيدروجين المثارة في المستوى الرابع عند عودة الإلكترون فيها إلى المستوى الثاني.
n1 = 2 , n2 = 4
ΔE = RH ( – )
ΔE = 2.18 x 10-18 ( – )
ΔE = 2.18 x 10-18 ( – )
ΔE = 2.18 x 10-18 () = 0.41 x 10-18 J
السؤال الخامس:
أدرس الشكل الآتي الذي يبين طيف الانبعاث لذرة الهيدروجين، ثم أجيب عن السؤالين التاليين:
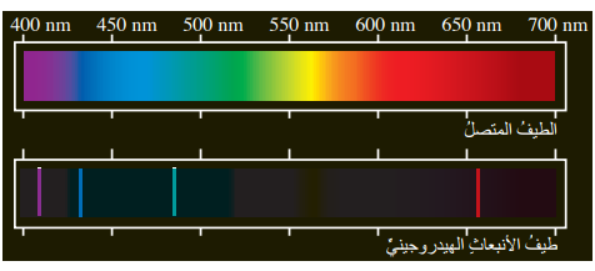
أ- أجد رقم المستوى الذي ينتقل منه الإلكترون إذا كانت طاقة فوتون الضوء الناجمة عن انتقاله إلى المستوى الثاني هي (0.21 RH) جول.
n1 = 2 , n2 = ??
ΔE = RH ( – )
0.21 RH = RH ( – )
0.21 = ( – )
0.21 - 0.25 = –
-0.04 = –
n2 = = 25
n = = 5
ب- أستنتج موقع هذا الخط ولونه ضمن الطيف المرئي لذرة الهيدروجين.
يقع في منطقة الضوء المرئي، ولون الخط أزرق.
السؤال السادس:
أعبر بدلالة (RH) عن مقدار الطاقة اللازم لنقل الإلكترون من المستوى الثاني إلى المستوى الخامس في ذرة الهيدروجين.
n1 = 2 , n2 = 5
ΔE = RH ( – )
ΔE = RH ( – )
ΔE = RH ( – )
ΔE = RH () = 0.21RH J
السؤال السابع:
تستخدم الإذاعة الأردنية موجاتٍ عدّة ذات ترددات متباينة في بثها الموجّه إلى مناطق مختلفة في الأردن، ومناطق واسعة في مختلف أنحاء العالم. ومن هذه الترددات:

أ- أجد الطول الموجي لكل تردد.

ب- أجد طاقة الفوتون المحتملة لكل تردد.

ج- أيهما يمثل التردد لموجة FM : نموذج شكل الموجة A أم نموذج شكل الموجة B؟

الموجة (FM) هي أقصر الموجات، ويمثلها النموذج (B).
السؤال الثامن:
أدرس الشكل، ثم أحدد خط الامتصاص الذي يوافق:

أدرس الشكل، ثم أحدد خط الامتصاص الذي يوافق:
أ- الطول الموجي الأقصر.
R
ب- الطول الموجي الأطول.
Z
ج- التردد الأعلى.
R
د- أقل طاقة.
Z
السؤال التاسع:
ذرة هيدروجين مثارة في مستوى مجهول، يتطلب تحويلها إلى أيون موجب أن تزود بكمية من الطاقة مقدارها (0.11 RH) جول. أحسب رقم المستوى الذي يوجد فيه الإلكترون؟
لتحويل الذرة إلى أيون موجب، يجب نقل الإلكترون إلى مستوى اللانهاية، حيث لا يخضع لجذب الذرة، أي إن الذرة تفقد هذا الإلكترون، ما يعني أنّ:
n1 = ?? , n2 = ∞
ΔE = RH ( – )
0.11 RH = RH ( – )
0.11 = ()
n2 = = 9
n = 3
السؤال العاشر:
إذا كان طول موجة الإشعاع المرافق لعودة الإلكترون من مستوى بعيد إلى المستوى الأول في ذرة هيدروجين هو (121) نانومتراً، فأجد:
أ- طاقة هذا الإشعاع.

ب- رقم المستوى الأعلى الذي عاد منه الإلكترون.
n1 = 1 , n2 = ??
ΔE = RH ( – )
1.64 x 10-18 = 2.18 x 10-18 ( – )
0.75 = 1 -
0.25 =
n2 = = 4
n = 2
السؤال الحادي عشر:
عدد الكم الرئيس لإلكترون (n=3):
أ- ما عدد المستويات الفرعية المحتملة؟
(3) مستويات فرعية.
ب- ما عدد الأفلاك في هذا المستوى؟
(9) أفلاك.
ج- ما السعة القصوى من الإلكترونات التي يمكن أن يستوعبها هذا المستوى؟
(18) إلكترون.
د- ما قيم أعداد الكم الفرعية (l)؟
(l = 0 , 1 , 2).
السؤال الثاني عشر:
أستنتج رمز المستوى الفرعي ذي القيم الكميّة المبيّنة في كل من الحالتين الآتيتين:
أ- l = 0 , n=2 ؟
2s
ب- l = 1 , n=4 ؟
4p
السؤال الثالث عشر:
أضع دائرة حول رمز الإجابة الصحيحة لكل جملةٍ ممّا يأتي:
1- النموذج أو الافتراض الذي يشير إلى وجود خصائص موجية للإلكترون هو:
أ- آراء بلانك وأينشتاين.
ب- نموذج رذرفورد.
ج- النموذج الميكانيكي الموجي.
د- نموذج بور.
2- الفكرة التي قدمها بور عن الذرة هي:
أ- لكل فلك حجم، وشكل، واتجاه خاص به.
ب- طاقة الإلكترون لا تتغير ما لم يُغادر مستواه.
ج- للضوء طبيعة مزدوجة (مادية – وموجية).
د- لكل مستوى سعة محددة من الإلكترونات.
3- الخاصية الفيزيائية المرتبطة بعدد الكم الفرعي هي:
أ- معدل البعد عن النواة.
ب- الشكل العام للفلك.
ج- الاتجاه الفراغي للفلك.
د- اتجاه الغزل.
4- لا تتماثل أفلاك (p) ضمن المستوى الرئيس الواحد نفسه في إحدى الخصائص الآتية:
أ- الاتجاه الفراغي.
ب- الشكل.
ج- الطاقة.
د- السعة من الإلكترونات.
5- عدد الأفلاك الكلي في المستوى الرئيس الثالث (n=3) هو:
أ- (3) أفلاك.
ب- (6) أفلاك.
ج- (9) أفلاك.
د- (18) فلكاً.
6- أكبر عدد من الإلكترونات التي قد توجد في المستوى الرئيس الخامس (n=5) هو:
أ- (5) إلكترونات.
ب- (10) إلكترونات.
ج- (25) إلكتروناً.
د- (50) إلكتروناً.
7- يتحدد الاتجاه الفراغي للفلك بعدد الكم:
أ- الرئيس.
ب- الفرعي.
ج- المغناطيسي.
د- المغزلي.
8- عند امتصاص الذرة للطاقة تنتقل الإلكترونات إلى مستويات طاقة أبعد عن النواة، فينشأ ما يُسمّى:
أ- التفريغ الكهربائي.
ب- الذرة المثارة.
ج- عملية التأين.
د- الطيف الذري.
9- أقصى عدد من الإلكترونات يستوعبه المستوى الفرعي (4f) هو:
أ- إلكترونان.
ب- (10) إلكترونات.
ج- (6) إلكترونات.
د- (14) إلكتروناً.
11- الرمز الذي يتعارض مع مبدأ باولي هو:
أ- (4d12).
ب- (3s1).
ج- (2p5).
د- (4f12).
11- عدد المستويات الفرعية المحتملة لوجود إلكترون في المستوى الثالث هو:
أ- (3) مستويات.
ب- (9) مستويات.
ج- (12) مستوى.
د- (16) مستوى.
إعداد : شبكة منهاجي التعليمية
07 / 10 / 2025
النقاشات
Klyrex كلاي ريكس
السؤال الثالث فرع أ الإجابة النهائية خاطئة المفروض عشرة للقوة سالب 19
إضافة رد
1 ردود
إدارة الموقع
كلامك صحيح شكراً لتنبيهنا. تم التعديل.