مفهوم أرهينيوس
Arrhenius Consept
تمكن أرهينيوس من وضع تصور حول مفهوم الحمض والقاعدة عن طريق دراسة التوصيل الكهربائي لمحاليل المواد الأيونية.
الحمض: مادة تتأين في الماء وتنتج أيون الهيدروجين (+H).
شروط حمض أرهينيوس:
- يجب أن يحتوي الحمض على ذرة هيدروجين (H) قابلة للتأين.
- يجب أن يذاب الحمض في الماء.
تمكن أرهينيوس من تفسير السلوك الحمضي للحموض:
- أحادية البروتون (تحتوي على ذرة هيدروجين).
مثل: حمض الهيدروكلوريك HCl، وحمض النيتريك HNO3، وحمض الإيثانويك CH3COOH
- ثنائية البروتون (تحتوي على ذرتي هيدروجين).
مثل: حمض الكبريتيك H2SO4، وحمض الكربونيك H2CO3
- ثلاثية البروتون (تحتوي على ثلاث ذرات هيدروجين).
مثل: حمض الفوسفوريك H3PO4
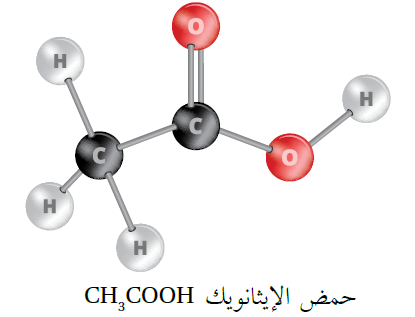 الحموض الكربوكسيلية مثل حمض الإيثانويك CH3COOH وحمض الميثانويك HCOOH تعتبر حموض أحادية البروتون؛ لأن ذرات الهيدروجين المرتبطة بالكربون ليس لها القدرة على التأين؛ لأن الروابط بينها غير قطبية مما يمنع تأينها، وتتأين فقط ذرة الهيدروجين المرتبطة بالأكسجين ذات السالبية الكهربائية العالية.
الحموض الكربوكسيلية مثل حمض الإيثانويك CH3COOH وحمض الميثانويك HCOOH تعتبر حموض أحادية البروتون؛ لأن ذرات الهيدروجين المرتبطة بالكربون ليس لها القدرة على التأين؛ لأن الروابط بينها غير قطبية مما يمنع تأينها، وتتأين فقط ذرة الهيدروجين المرتبطة بالأكسجين ذات السالبية الكهربائية العالية.
يعبر عن التفكك الكلي لحمض أرهينيوس القوي بسهم أحادي الاتجاه، ويعبر عن التفكك الجزئي لحمض أرهينيوس الضعيف بسهم ثنائي الاتجاه، ويوضع الماء على السهم.
أمثلة:
HCl (g) H+ (aq) + Cl- (aq)
HClO4 (l) H+ (aq) + ClO4-(aq)
CH3COOH (l) H+ (aq) + CH3COO- (aq)
القاعدة: مادة تتأين في الماء وتنتج أيون الهيدروكسيد (-OH).

شروط قاعدة أرهينيوس:
- يجب أن تحتوي على مجموعة هيدروكسيد (OH-).
- يجب أن تذاب في الماء.
تمكن أرهينيوس من تفسير السلوك القاعدي للقواعد:
- أحادية الهيدروكسيد (تحتوي على مجموعة هيدروكسيد).
مثل: هيدروكسيد الصوديوم NaOH، وهيدروكسيد البوتاسيوم KOH ، وهيدروكسيد الليثيوم LiOH.
- ثنائية الهيدروكسيد (تحتوي على مجموعتي هيدروكسيد).
مثل: هيدروكسيد الكالسيوم Ca(OH)2، وهيدروكسيد المغنيسيوم Mg(OH)2 .
يعبر عن التفكك الكلي لقاعدة أرهينيوس بسهم أحادي الاتجاه، ويوضع الماء على السهم.
أمثلة:
NaOH (s) Na+ (aq) + OH- (aq)
KOH (s) K+ (aq) + OH- (aq)
سؤال 1 :
فسّر مستعيناً بمعادلات سلوك كلّ من محاليل الحموض والقواعد التالية وفق مفهوم أرهينيوس:
1- السلوك الحمضي لحمض البيركلوريك HClO4 .
2- السلوك الحمضي لحمض الهيدروفلوريك HF .
3- السلوك القاعدي لهيدروكسيد الليثيوم LiOH .
سؤال 2 :
أصنف المواد الآتية إلى حموض وقواعد وفق مفهوم أرهينيوس:
HClO4 , KOH , HNO3 , HCOOH , Ba(OH)2
أوجه القصور في تعريف أرهينيوس
- تناول التعريف الحموض والقواعد في المحاليل المائية فقط.
- اقتصر التعريف على الحموض التي تحتوي على (H).
- اقتصر التعريف على القواعد التي تحتوي على (OH)، وعليه لم يتمكن من تفسير السلوك القاعدي لبعض القواعد مثل الأمونيا NH3 .
- عجز التعريف عن تفسير الخواص الحمضية أو القاعدية لكثير من الأملاح مثل: NH4Cl ، NaHCO3.
- لم يتمكن من تفسير كثير من تفاعلات الحموض والقواعد، مثل تفاعل حمض الهيدروكلوريك HCl مع الأمونيا NH3 الذي ينتج ملح NH4Cl ، سواء في المحاليل أو في الحالة الغازية:
NH3 (aq) + HCl (aq) → NH4Cl (aq)
NH3 (g) + HCl (g) → NH4Cl (s)
في الملفات المرفقة أسئلة موضوعية على مفهوم أرهينيوس مع إجاباتها.
في الملفات المرفقة إجابات أسئلة درس مفهوم أرهينيوس.
إعداد : أ. أحمد الحسين
14 / 08 / 2024
النقاشات