مراجعة الدرس الثالث
1- الفكرة الرئيسة: أوضح العلاقة بين ثابت تأين الحمض الضعيف ورقمه الهيدروجيني.
2- أحسب تركيز H3O+ و OH- في كل من المحاليل الآتية:
أ- محلول HNO2 تركيزه 0.02 M
ب- محلول NH3 تركيزه 0.01 M
3- أفسر: بزيادة ثابت التأين يزداد تركيز OH- في محلول القاعدة الضعيفة.
4- أطبق: يبين الجدول المجاور قيم ثابت تأين عدد من الحموض الضعيفة. أدرس هذه القيم، ثم أجيب عن الأسئلة الآتية:
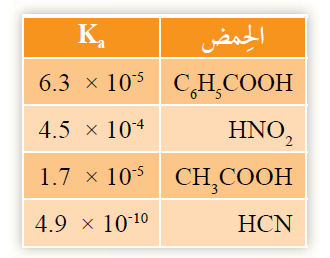 أ- أكتب صيغة القاعدة المرافقة التي لها أعلى قيمة pH .
أ- أكتب صيغة القاعدة المرافقة التي لها أعلى قيمة pH .
ب- أحدد أي محلول الحموض له أقل رقم هيدروجيني HNO2 أم HCN .
ج- أستنتج: الحمض الذي يكون تركيز H3O+ فيه أقل ما يمكن.
د- أتوقع الحمض الذي يحتوي محلوله على أقل تركيز من أيونات OH-
هـ- أحسب الرقم الهيدروجيني لمحلول HCN ، الذي تركيزه 0.1 M
و- أحسب الرقم الهيدروجيني pH لمحلول CH3COOH حضر بإذابة 12 g منه في 400 mL من الماء. علماً أن (الكتلة المولية للحمض CH3COOH = 60 g/mol).
5- يبين الجدول قيم Kb لعدد من القواعد الضعيفة. أدرسها، ثم أجيب عن الأسئلة الآتية:
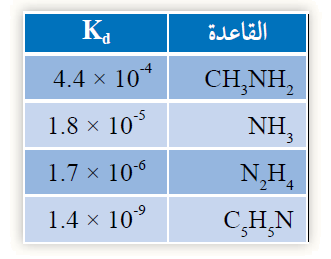 أ- أكتب صيغة الحمض المرافق الذي له أقل pH .
أ- أكتب صيغة الحمض المرافق الذي له أقل pH .
ب- أحدد أي القواعد يحتوي محلولها على أقل تركيز من H3O+ .
ج- أستنتج أي القواعد أكثر تأيناً في الماء.
د- أحلل: أكمل المعادلة الآتية، ثم أعين الزوجين المترافقين:
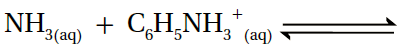
هـ- أحسب كتلة القاعدة N2H4 اللازم إضافتها إلى 400 mL من الماء لتحضير محلول منها رقمه الهيدروجيني يساوي 9.4 . علماً أن الكتلة المولية للقاعدة N2H4 تساوي 32 g/mol ، وأن log 3.9 = 0.6 .
إعداد : شبكة منهاجي التعليمية
06 / 07 / 2022
النقاشات