مراجعة الدرس الثاني
1- الفكرة الرئيسة: كيف تنتج الخلية الجلفانية الطاقة الكهربائية؟
2- أوضح المقصود بكل من:
- القنطرة الملحية.
- جهد الاختزال المعياري.
3- خلية جلفانية يحدث فيها التفاعل الآتي:
Co + Cu2+ → Co2+ + Cu
أ- أحدد فيها المصعد والمهبط.
ب- أكتب نصفي تفاعل التأكسد والاختزال.
ج- أحسب جهد الخلية المعياري، وأكتب تعبيراً رمزياً للخلية الجلفانية.
د- ما التغير الذي يحدث لكتلة كلا القطبين؟
4- نصفا التفاعل الآتيان يشكلان خلية جلفانية في الظروف المعيارية:
I2 (s) + 2e- → 2I- Eo = 0.54 V
Fe2+ (aq) + 2e- → Fe (s) Eo = - 0.44 V
أجيب عن الأسئلة الآتية المتعلقة بهما:
أ- أكتب معادلة التفاعل الكلي في الخلية.
ب- أحسب جهد الخلية المعياري.
ج- ما التغير الذي يحدث لتركيز أيونات كل من I- و Fe2+ ؟
5- 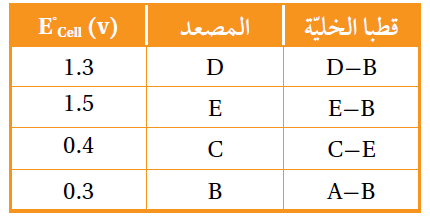 أدرس الجدول الآتي، الذي يوضح جهد الخلية المعياري لعدد من الخلايا الجلفانية المكونة من الفلزات ذوات الرموز (A,B,C,D,E)، وجميعها تكون أيونات ثنائية موجبة، ثم أجيب عن الأسئلة الآتية:
أدرس الجدول الآتي، الذي يوضح جهد الخلية المعياري لعدد من الخلايا الجلفانية المكونة من الفلزات ذوات الرموز (A,B,C,D,E)، وجميعها تكون أيونات ثنائية موجبة، ثم أجيب عن الأسئلة الآتية:
أ- أحدد الفلز الذي له أعلى جهد اختزال معياري: D أم C .
ب- أحدد أقوى عامل مؤكسد.
ج- أتنبأ: هل يمكن تحريك محلول نترات E بملعقة من A ؟ أفسر إجابتي.
د- أحدد اتجاه حركة الإلكترونات عبر الأسلاك في الخلية الجلفانية المكونة من نصف خلية E2+│E ونصف خلية D│D2+ .
هـ- أحسب جهد الخلية المعياري للخلية الجلفانية المكونة من نصف خلية C│C2+ ونصف خلية B│B2+ .
6- فلزان أعطيا الرموز الافتراضية A و B ، قيست جهود الاختزال المعيارية لنصفي الاختزال المعياريين المكونين لخلية جلفانية كالآتي:
A3+ + e- → A2+ Eo = 0.77 V
B+ + e- → B Eo = 0.80 V
أ- أكتب معادلة كيميائية للتفاعل الكلي في الخلية الجلفانية.
ب- أحسب Eo للتفاعل الكلي.
ج- أحدد العامل المؤكسد والعامل المختزل في التفاعل.
7- أدرس الجدول المجاور الذي يمثل جهود الاختزال المعيارية لبعض المواد، ثم أجيب عن الأسئلة الآتية:
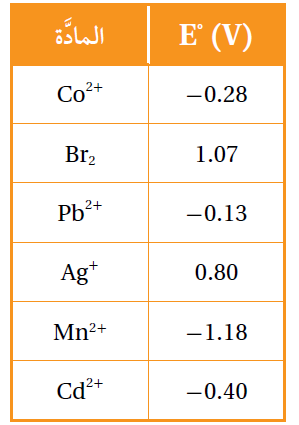 أ- أحدد أقوى عامل مؤكسد وأقوى عامل مختزل.
أ- أحدد أقوى عامل مؤكسد وأقوى عامل مختزل.
ب- أستنتج: هل يمكن حفظ محلول البروم Br2 في وعاء من الفضة؟ أفسر إجابتي.
ج- أقارن: ما الفلزين اللذين يكونان خلية جلفانية لها أكبر جهد خلية معياري.
د- أستنتج المادة التي تستطيع أكسدة Cd ولا تؤكسد Pb .
هـ- أحدد القطب الذي تزداد كتلته في الخلية الجلفانية (Cd-Pb).
و- أحدد الفلز الذي لا يحرر غاز الهيدروجين من محلول حمض HCl المخفف.
ز- في الخلية الجلفانية التي أعطيت الرمز الآتي:
Co(s)│Co2+(aq)││Sc3+(aq)│Sc(s)
إذا علمت أن جهد الخلية المعياري Eocell = 1.8 V ، فأجيب عن الأسئلة الآتية:
أ- أحدد اتجاه حركة الإلكترونات عبر الأسلاك في الخلية.
ب- أحسب جهد الاختزال المعياري لقطب السكانديوم Sc .
ج- أكتب معادلة التفاعل الكلي في الخلية.
إعداد : شبكة منهاجي التعليمية
10 / 07 / 2022
النقاشات