أسئلة المحتوى وإجاباتها
نظرية بور لذرة الهيدروجين
أتأمل الصورة صفحة (7):
- تدور الإلكترونات حول النواة في مستوياتٍ محددة من الطاقة، فما طاقة هذه المستويات؟
تتوزع الإلكترونات في الذرة على مستويات من الطاقة، وكل إلكترون يمتلك مقدارًا من الطاقة مساويًا لمقدار طاقة المستوى الموجود فيه.
- ما دلائل انتقال الإلكترون بين المستويات المختلفة للطاقة في الذرة؟
يعد طيف الانبعاث أو طيف الامتصاص أحد أهم الدلائل على انتقال الإلكترونات بين مستويات الطاقة.
تجربة استهلالية صفحة (9):
الطيف الذري
التحليل والاستنتاج:
1- كيف يظهر الضوء الصادر عن المصباح على الشاشة البيضاء؟ أصف ذلك.
يظهر ضوء المصباح العادي على الشاشة البيضاء في صورة مجموعة من الألوان المتتابعة المتداخلة على شكل قوس المطر، ويسمى الطيف المتصل.
2- أصف الضوء الصادر عن أنبوب التفريغ.
يظهر الضوء الصادر عن أنبوب التفريغ في صورة مجموعة من الخطوط الملونة المتباعدة، ويسمى الطيف المنفصل.
3- ما الفرق بين ألوان الضوء الصادر في كلتا الحالتين؟
الضوء العادي: سلسلة من الألوان المتتابعة المتداخلة، من دون وجود حد فاصل بين اللون واللون الذي يليه.
الضوء الصادر عن أنبوب التفريغ: مجموعة من الخطوط، لكل منها لون خاص به يمكن تمييزه من غيره.
الشكل (2) الطيف المستمر صفحة (11):
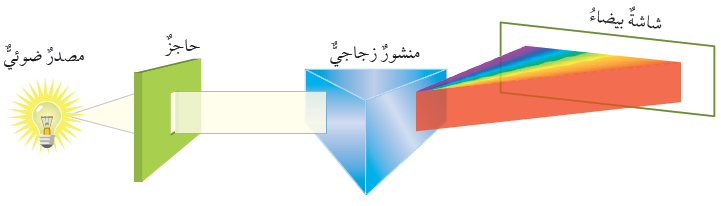
أفسر سبب تحلل الضوء بعد خروجه من المنشور.
عندما ينتقل الضوء بين وسطين مختلفين في الكثافة (مثل: الماء، والهواء)، فإن الأطوال الموجية المختلفة تنكسر (تنحرف) عن مسارها بزوايا مختلفة بناءً على تردد الإشعاع الضوئي وطوله؛ لذا يتشتت الضوء بعد خروجه من المنشور.
الشكل (4) التردد وعلاقته بطول الموجة صفحة (13):
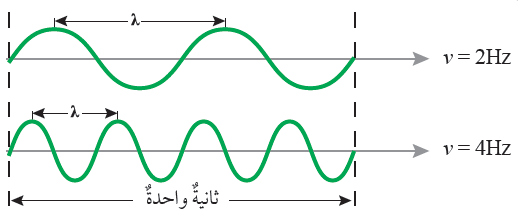
أقارن: أيهما أطول: الموجة الأولى أم الموجة الثانية؟
الموجة الأولى هي الأطول.
أفكر صفحة (15):
لماذا يختلف الطيف الذري من عنصر إلى آخر؟
بسبب اختلاف تركيب الذرة وبنيتها من عنصر إلى آخر، واختلاف عدد البروتونات، ومستويات الطاقة، وكيفية توزيع الإلكترونات فيها.
 أتحقق صفحة (15):
أتحقق صفحة (15):
أقارن بين الطيف المتصل والطيف الخطي.
الطيف المتصل ينتج من تحليل الضوء العادي أو ضوء الشمس خلال منشور زجاجي على شكل حزمة من الأشعة الملونة المتتابعة منن دور ظهور حدود فاصلة واضحة بينها.
أما الطيف الخطي فينتج من تحليل الضوء الصادر عن الذرات المثارة، مثل ضوء مصباح الصوديوم، أو ضوء مصباح الهيدروجين، ويظهر على شكل عدد من الخطوط الملونة المتباعدة التي يمتاز كل منها بطول موجة وتردد خاص به.
تجربة (1) صفحة (15):
اختلاف لون اللهب الصادر عن ذرات العناصر المختلفة
التحليل والاستنتاج:
التحليل والاستنتاج:
1- أفسر اختلاف لون اللهب من عنصر إلى آخر في المركبات السابقة؟
بسبب اختلاف تركيب الذرة وبنيتها من عنصر إلى آخر، واختلاف عدد البروتونات، ومستويات الطاقة، وكيفية توزيع الإلكترونات فيها.
2- اعتماداً على ألوان الطيف المرئي، أستنتج العلاقة بين لون اللهب وطاقته؟
بالانتقال من اللون الأحمر إلى اللون البفسجي كانت طاقته أعلى.
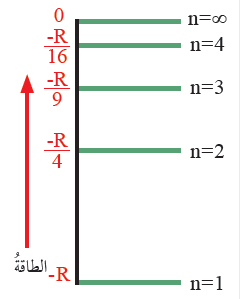 الشكل (8): صفحة (16):
الشكل (8): صفحة (16):
مستويات الطاقة في ذرة الهيدروجين.
أستنتج العلاقة بين رقم المستوى الرئيس في ذرة الهيدروجين وفرق الطاقة بين المستويات.
كلما زاد رقم المستوى الرئيس (n) زادت طاقته، وأصبحت المستويات أكثر قرباً من بعضها، وقلّ فرق الطاقة بينها.
الشكل (9): صفحة (18):
خطوط الطيف المنبعثة من ذرة الهيدروجين.
أفكر: ما عدد خطوط الطيف الناتجة عند عودة إلكترون ذرة الهيدروجين من المستوى السادس إلى المستوى الأول؟
عدد خطوط الطيف الناتجة عند عودة الكترون ذرة الهيدروجين من المستوى السادس إلى المستوى الأول (15).
 أتحقق صفحة (18):
أتحقق صفحة (18):
1- أحسب طاقة كل من المستوى الأول، والثاني، واللانهائي (∞) في ذرة الهيدروجين.
E1 = -2.18 x 10-18 J
E2 = -0.545 x 10-18 J
E∞ = 0
2- تحفيز: ما تردد الضوء المنبعث من ذرة هيدروجين مثارة في المستوى الرابع عند عودتها إلى حالة الاستقرار؟
ΔE = 2.04 x 10-18 J
v = 0.307 x 1016 s-1
إعداد : شبكة منهاجي التعليمية
04 / 07 / 2025
النقاشات