أسئلة وزارية (الكيمياء الحركية)
الدورات (2022-2020)
الطلبة النظاميون خطة 2020
اختر الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً بأن عدد الفقرات (13):
1- قيمة ثابت سرعة تفاعل ما k عند درجة حرارة معينة تساوي 0.1 M-2.s-1، الرتبة الكلية للتفاعل تساوي:
أ- 0
ب- 1
ج- 2
د- 3
2- يكون تركيز المواد المتفاعلة لتفاعل ما أعلى عند الزمن:
أ- 1 s
ب- 5 s
ج- 10 s
د- 15 s
3- في التفاعل 2A → F + C ، إذا كانت قيمة k = 2 x 10-3 M-1.s-1 عند درجة حرارة معينة، فإنّ سرعة هذا التفاعل (M.s-1) عندما يكون تركيز A = 0.1 M، تساوي:
أ- 2 x 10-3
ب- 2 x 10-4
ج- 2 x 10-5
د- 2 x 10-6
4- تفاعل ما رتبته الكلية تساوي (1) عند درجة حرارة معيّنة، تكون وحدة قياس ثابت سرعة هذا التفاعل k:
أ- s-1
ب- L/mol
ج- L/mol.s
د- mol/L.s
5- في التفاعل الافتراضي نواتج A → ، قانون سرعة التفاعل R = k [A]2 عند درجة حرارة معينة، [A] = 0.2 M ، وسرعة التفاعل = 1.6 x 10-9 M.s-1، فإن قيمة k تساوي:
أ- 8 x 10-9 M-1.s-1
ب- 8 x 10-9 s-1
ج- 4 x 10-8 M-1.s-1
د- 4 x 10-8 s-1
6- في التفاعل نواتج A + B + C → ، رتبة التفاعل للمادة A = 1، رتبة التفاعل للمادة B = 2، ورتبة التفاعل الكلية = 3 عند درجة حرارة معينة فإن قانون سرعة التفاعل هو:
أ- R = k [A]1 [B]2
ب- R = k [A]1 [B]1 [C]1
ج- R = k [A]1 [C]2
د- R = k [A]2 [B]1
7- تتناقص سرعة التفاعل الكيميائي بمرور الزمن بسبب:
أ- زيادة عدد التصادمات الكلية.
ب- تناقص تركيز المواد المتفاعلة.
ج- تناقص تركيز المواد الناتجة.
د- زيادة تركيز المواد المتفاعلة.
8- استخدام أكسيد المنغنيز MnO2 في تحلل فوق أكسيد الهيدروجين H2O2 عند درجة حرارة معينة، يعمل على تقليل:
أ- سرعة التفاعل
ب- التغير في DH
ج- طاقة النواتج
د- زمن ظهور النواتج
9- سرعة تفاعل قطعة من الصوديوم Na مع الماء أكبر من سرعة تفاعل قطعة من المغنيسيوم Mg مع الماء لهما الكتلة نفسها، فإن العامل المؤثر في سرعة هذا التفاعل، هو:
أ- مساحة السطح.
ب- تركيز المواد.
ج- طبيعة المادة.
د- درجة الحرارة.
10- خفض درجة الحرارة في التفاعل يؤدي إلى:
أ- نقصان طاقة التنشيط.
ب- زيادة عدد التصادمات الفعالة.
ج- زيادة طاقة التنشيط.
د- نقصان عدد التصادمات الفعالة.
- ادرس المعلومات الواردة في الجدول، وأجب عن الفقرات (11، 12، 13)

11- قيمة التغير في المحتوى الحراري HD (kJ) تساوي:
أ- -80
ب- +80
ج- -240
د- +240
12- قيمة طاقة المعقد المنشط (kJ) بوجود عامل مساعد تساوي:
أ- 40
ب- 155
ج- 175
د- 200
13- قيمة طاقة التنشيط للتفاعل العكسي (kJ) بدون عامل مساعد تساوي:
أ- 40
ب- 60
ج- 95
د- 120
طلبة الدراسات الخاصة خطة 2020
اختر الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً بأن عدد الفقرات (12):
- ادرس معلومات الجدول الآتي لتفاعل ما، ثم أجب عن الفقرات (1، 2، 3)

1- قيمة طاقة المعقد المنشط (kJ) يساوي:
أ- 250
ب- 260
ج- 220
د- 200
2- قيمة طاقة التنشيط للتفاعل الأمامي (kJ) يساوي:
أ- 210
ب- 220
ج- 230
د- 250
3- قيمة HD التفاعل (kJ) يساوي:
أ- +220
ب- -220
ج- +240
د- -240
4- ارتفاع درجة حرارة التفاعل تؤدي إلى:
أ- زيادة طاقة التنشيط
ب- نقصان طاقة التنشيط
ج- زيادة DH
د- زيادة عدد الجسيمات التي تمتلك طاقة التنشيط
- ادرس معلومات الجدول الآتي الذي يمثل التفاعل الافتراضي A + B → 2C ، عند درجة حرارة معيّنة، علماً بأن الرتبة الكلية للتفاعل تساوي (1)، ثم أجب عن الفقرات (5، 6، 7)
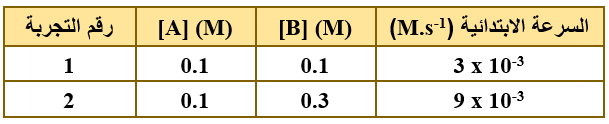
5- رتبة التفاعل بالنسبة للمادة A هو:
أ- 0
ب- 1
ج- 2
د- 3
6- رتبة التفاعل بالنسبة للمادة B هو:
أ- 0
ب- 1
ج- 2
د- 3
7- قيمة ثابت سرعة التفاعل k يساوي:
أ- 3 x 10-3
ب- 1 x 10-3
ج- 3 x 10-2
د- 1 x 10-2
8- إضافة العامل المساعد إلى التفاعل يؤدي إلى زيادة:
أ- طاقة التنشيط
ب- DH
ج- سرعة التفاعل
د- طاقة المتفاعلات
9- إذا علمت أن قانون السرعة لهذا التفاعل: CH3Cl + H2O → CH3OH + HCl هو:
R = k [CH3Cl]1 [H2O]2 وسرعة التفاعل = 1.2 M.s-1 عندما يكون [CH3Cl] = 0.1 M = [H2O] فإن قيمة ثابت سرعة التفاعل k تساوي:
أ- 1.2 x 10-2
ب- 1.2 x 10-3
ج- 1.2 x 102
د- 1.2 x 103
10- تفاعل افتراضي قيمة ثابت السرعة له k = 4 x 10-8 M-1.s-1 فإن رتبة التفاعل الكلية تساوي:
أ- 0
ب- 1
ج- 2
د- 3
11- إذا علمت أن ثابت سرعة التفاعل الافتراضي: نواتج A → عند درجة حرارة 25oC يساوي 1.6 x 10-2 s-1فإن قانون السرعة لهذا التفاعل هو:
أ- R = k
ب- R = k [A]1
ج- R = k [A]2
د- R = k [A]3
12- أبطأ سرعة تفاعل لـِ (4 g) من المغنيسيوم مع محلول HCl عندما يكون تركيزه:
أ- 0.001 M
ب- 0.01 M
ج- 0.1 M
د- 1 M
الطلبة النظاميون الدورة التكميلية خطة 2020
اختر الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً بأن عدد الفقرات (18):
1- قانون سرعة التفاعل ما هو R = k [A]x عند درجة حرارة معينة، فإن العبارة الصحيحة في ما يتعلق بقيمة x :
أ- تبين أثر تركيز المتفاعلات في سرعة التفاعل.
ب- تساوي تركيز المواد المتفاعلة.
ج- تساوي عدد مولات المواد المتفاعلة.
د- لا تحسب من التجربة العملية.
2- في التفاعل الافتراضي نواتج →A ، إذا كانت قيمة= 2 x 10-3 M-1.s-1 k عند درجة حرارة معينة، فإن سرعة التفاعل (M/s) عندما يكون تركيز= 0.2 M A ، تساوي:
أ- 4 x 10-4
ب- 4 x 10-5
ج- 8 x 10-4
د- 8 x 10-5
3- الرتبة الكلية لتفاعل ما تساوي (1) عند درجة حرارة معيّنة، فإن وحدة ثابت السرعة k لهذا التفاعل،هي:
أ- s-1
ب- M
ج- M.s-1
د- M.s
4- في التفاعل الافتراضي C A → ، قانون سرعة التفاعل R = k [A]1 عند درجة حرارة معينة، وتركيز [A] = (0.02 M)، وسرعة التفاعل = 2.4 x 10-6 M/s، فإن قيمة k تساوي:
أ- 1.2 x 10-2
ب- 1.2 x 10-4
ج- 4.8 x 10-2
د- 4.8 x 10-4
5- في التفاعل الافتراضي: نواتج A + B → ، رتبة التفاعل للمادة B = 2، والرتبة الكلية للتفاعل = 3 عند درجة حرارة معينة، فإن قانون سرعة التفاعل هو:
أ- R = k [A]1 [B]2
ب- R = k [A]1 [B]1
ج- R = k [A]2 [B]2
د- R = k [A]1
6- في التفاعل NO2 + HCl → NO + H2O + Cl2 عند مضاعفة تركيز NO2 مرتين تتضاعف سرعة التفاعل مرتين، فإن رتبة التفاعل بالنسبة للمادة NO2 تساوي:
أ- 0
ب- 1
ج- 2
د- 3
7- إذا كانت قيمة ثابت سرعة تفاعل ما k عند درجة حرارة معينة تساوي (0.2 M-2.s-1)، فإنّ الرتبة الكلية لهذا التفاعل، تساوي:
أ- 0
ب- 1
ج- 2
د- 3
8- في التفاعل الافتراضي A2 + B2 → 2AB + 30KJ طاقة التنشيط للتفاعل الأمامي (50 kJ)، فإن طاقة التنشيط للتفاعل العكسي (kJ) تساوي:
أ- 80
ب- 40
ج- 20
د- 10
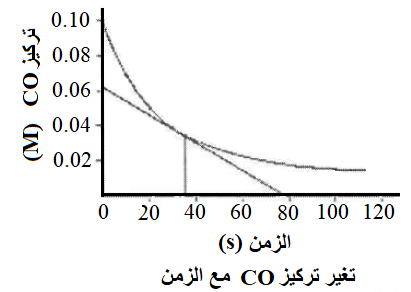 يمثل الشكل المجاور العلاقة بين تغير تركيز CO مع الزمن للتفاعل
يمثل الشكل المجاور العلاقة بين تغير تركيز CO مع الزمن للتفاعل
CO + NO2 CO2 → CO2 + NO ادرس الشكل، ثم أجب عن الفقرتين (9، 10)
9- تركيز CO (M) في بداية التفاعل يساوي:
أ- 0.02
ب- 0.06
ج- 0.08
د- 0.10
10- يكون تركيز CO الأقل عند الزمن (s):
أ- 100
ب- 60
ج- 40
د- 0
11- يمثل قانون سرعة تفاعل ما؛ العلاقة بين:
أ- سرعة التفاعل ودرجة الحرارة.
ب- سرعة التفاعل والتركيز.
ج- درجة الحرارة والتركيز.
د- الطاقة والتركيز.
12- بالاعتماد على نظرية التصادم فإن زيادة درجة حرارة تفاعل ما تؤدي إلى زيادة سرعته بسبب:
أ- انخفاض متوسط الطاقة الحركية للجسيمات.
ب- انخفاض عدد التصادمات الفعالة.
ج- زيادة عدد الجسيمات التي تمتلك طاقة التنشيط.
د- زيادة طاقة التنشيط التي تمتلكها الجسيمات.
13- استخدام عامل مساعد في تحلل فوق أكسيد الهيدروجين H2O2 لا يؤثر في:
أ- سرعة التفاعل
ب- طاقة التنشيط
ج- زمن ظهور النواتج
د- DH للتفاعل
14- احتراق نشارة الخشب أسرع من احتراق قطعة الخشب لهما الكتلة نفسها وعند الظروف نفسها، العامل الذي يؤثر في سرعة هذا التفاعل، هو:
أ- تركيز المواد المتفاعلة
ب- طبيعة المادة المتفاعلة
ج- مساحة السطح
د- درجة الحرارة
- ادرس المعلومات الآتية، وأجب عن الفقرات (15، 16، 17)
إذا كانت قيم الطاقات (kJ) لتفاعل افتراضي، هي:
المواد المتفاعلة (110)، المواد الناتجة (20)، طاقة التنشيط للتفاعل الأمامي بوجود عامل مساعد (15)، طاقة المعقد المنشط بدون عامل مساعد (150).
15- قيمة التغير في المحتوى الحراري DH (kJ) تساوي:
أ- -90
ب- +90
ج- -130
د- +130
16- قيمة طاقة المعقد المنشط (kJ) بوجود عامل مساعد تساوي:
أ- 30
ب- 95
ج- 125
د- 150
17- قيمة طاقة التنشيط للتفاعل العكسي (kJ) بدون عامل مساعد تساوي:
أ- 30
ب- 40
ج- 115
د- 130
18- إضافة العامل المساعد لتفاعل ما يؤدي إلى انخفاض:
أ- طاقة المواد المتفاعلة.
ب- طاقة المواد الناتجة.
ج- التغير في المحتوى الحراري.
د- طاقة التنشيط للتفاعل الأمامي.
دورة 2021
اختر الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً بأن عدد الفقرات (17):
1- يحدث التفاعل الآتي CO + NO2 → CO2 + NO عند درجة حرارة معينة، فإن العبارة الصحيحة المتعلقة بالتفاعل بمرور الزمن هي:
أ- تبقى سرعة التفاعل ثابتة.
ب- يقل تركيز CO
ج- يقل تركيز CO2
د- تزداد سرعة التفاعل.
- التفاعل الافتراضي: نواتج →X + Y عند درجة حرارة معينة، تم الحصول على البيانات في الجدول أدناه، ادرسه ثم أجب عن الفقرات (2، 3، 4، 5) علماً أن قيمة ثابت سرعة التفاعل k = 2.2 x 10-4 M-1.s-1
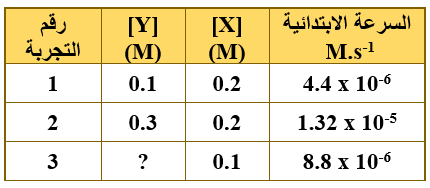
2- رتبة التفاعل بالنسبة إلى المادة Y تساوي:
أ- 0
ب- 1
ج- 2
د- 3
3- قانون سرعة هذا التفاعل هو:
أ- R = k [X]2
ب- R = k [X]1 [Y]1
ج- R = k [Y]2
د- R = k [X]1 [Y]2
4- تركيز المادة Y (M) في التجربة رقم (3) يساوي:
أ- 0.3
ب- 3
ج- 4
د- 0.4
5- تقليل تركيز المادة X في التفاعل مع ثبات العوامل الأخرى يؤدي إلى:
أ- زيادة زمن ظهور النواتج.
ب- زيادة سرعة استهلاك المادة X
ج- نقصان زمن ظهور النواتج.
د- زيادة عدد التصادمات الفعالة.
6- في التفاعل الافتراضي: A + 40KJ → B عند درجة حرارة معينة، إذا علمت أن قيمة طاقة التنشيط للتفاعل العكسي تساوي نصف قيمة طاقة التنشيط للتفاعل الأمامي، فإن قيمة طاقة التنشيط للتفاعل العكسي (kJ) تساوي:
أ- 20
ب- 40
ج- 60
د- 80
7- تفاعل افتراضي: A → B تم فيه متابعة أثر تركيز المادة A في سرعة التفاعل في تجربتين عند درجة الحرارة نفسها، فإذا كان تركيز المادة A في التجربة الأولى يساوي (0.02 M)، وقيمة ثابت سرعة التفاعل k تساوي (0.2 M-1.s-1)، فإذا تم مضاعفة تركيز المادة A في التجربة الثانية مرتين، فإن سرعة التفاعل (M/s) في التجربة الثانية تساوي:
أ- 8 x 10-5
ب- 16 x 10-5
ج- 24 x 10-5
د- 32 x 10-5
8- يحدث التفاعل: CH3CHO → CH4 + CO ، عند درجة حرارة معينة، فإذا كانت قيمة ثابت سرعة التفاعل k = 2.5 x 10-4 M-1.s-1، وسرعة التفاعل = 1 x 10-5 M.s-1، فإن تركيز [CH3CHO] (M) يساوي:
أ- 0.04
ب- 0.4
ج- 0.02
د- 0.2
9- الشكل الذي يمثل بناء المعقد المنشط للتفاعل 2AB → A2 + B2:
أ- B…B…A…A
ب- A…B…A…B
ج- 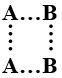
د- 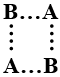
- في التفاعل الافتراضي: + 40KJ A + B → 2C عند درجة حرارة معينة، إذا علمت أن طاقة المواد المتفاعلة = (70 kJ)، طاقة التنشيط للتفاعل الأمامي بدون عامل مساعد = (110 kJ)، وعند إضافة العامل المساعد إلى وعاء التفاعل انخفضت طاقة التنشيط للتفاعل العكسي بمقدار (10 kJ).
اعتماداً على المعلومات أعلاه، أجب عن الأسئلة (10، 11، 12، 13).
10- قيمة طاقة التنشيط للتفاعل العكسي (kJ) بوجود عامل مساعد، تساوي:
أ- 60
ب- 70
ج- 110
د- 140
11- طاقة المعقد المنشط (kJ) بوجود العامل المساعد، تساوي:
أ- 130
ب- 150
ج- 170
د- 180
12- طاقة التنشيط للتفاعل الأمامي (kJ) بوجود عامل مساعد، تساوي:
أ- 120
ب- 100
ج- 80
د- 70
13- طاقة المواد الناتجة (kJ)، تساوي:
أ- 30
ب- 60
ج- 90
د- 110
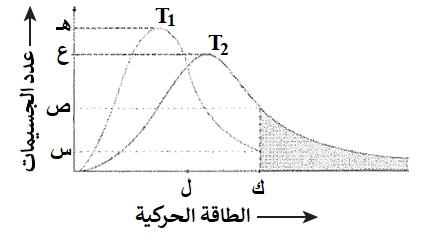 الشكل المجاور يمثل توزيع الطاقة الحركية على جزيئات غاز ما عند درجتي حرارة مختلفتين (T1 , T2)، ادرسه ثم أجب عن الفقرتين (14، 15).
الشكل المجاور يمثل توزيع الطاقة الحركية على جزيئات غاز ما عند درجتي حرارة مختلفتين (T1 , T2)، ادرسه ثم أجب عن الفقرتين (14، 15).
14- الرمز الذي يمثل عدد الجسيمات التي تمتلك طاقة التنشيط عند درجة الحرارة الأعلى هو:
أ- س
ب- ص
ج- ع
د- هـ
15- زيادة درجة حرارة التفاعل لا يؤثر في:
أ- عدد التصادمات الفعالة.
ب- سرعة التفاعل الكيميائي.
ج- طاقة التنشيط للتفاعل.
د- متوسط الطاقة الحركية للجسيمات.
- في التفاعل الافتراضي: 2AB + 50kJ → A2 + B2 ، إذا كانت طاقة التنشيط للتفاعل العكسي (80 kJ) وطاقة المعقد المنشط (170 kJ)، أجب عن الفقرتين (16، 17).
16- عند إضافة العامل المساعد إلى التفاعل أعلاه فإن قيمة:
أ- DH أكبر من (50 kJ).
ب- DH أقل من (50 kJ).
ج- طاقة المعقد المنشط أكبر من (170 kJ).
د- طاقة المعقد المنشط أقل من (170 kJ).
17- طاقة المواد المتفاعلة (kJ)، تساوي:
أ- 90
ب- 70
ج- 50
د- 40
الدورة التكميلية 2021
اختر رمز الإجابة الصحيحة في كل فقرة مما يأتي، ثم ظلل بشكل غامق الدائرة التي تشير إلى رمز الإجابة في نموذج الإجابة (ورقة القارىء الضوئي) فهو النموذج المعتمد (فقط) لاحتساب علامتك، علماً أن عدد الفقرات (16):
1- في التفاعل الافتراضي الآتي: A + B → AB ، توفرت لديك المعلومات الآتية للتفاعل عند درجة حرارة معينة:
- سرعة التفاعل تساوي 8.1 x 10-6 M.s-1، عندما= 0.3 M [A] = [B]
- رتبة التفاعل للمادة A = 2 ، ورتبة التفاعل للمادة B = 1
فإذا كانت سرعة التفاعل = 0.6 x 10-6 M.s-1، عندما= 0.1 M [A] فإن [B] (M)، يساوي:
أ- 0.02
ب- 0.2
ج- 0.1
د- 0.01
2- عند إضافة أكسيد المنغنيز MnO2 إلى تفاعل تحلل فوق أكسيد الهيدروجين H2O2 عند درجة حرارة معينة، فإن:
أ- سرعة التفاعل تقل.
ب- قيمة DH تزداد.
ج- طاقة المعقد المنشط تقل.
د- زمن ظهور النواتج يزداد.
3- يمكن حساب سرعة تفاعل ما عند زمن محدد من خلال إيجاد ميل مماس لمنحنى يُمثل العلاقة بين:
أ- تركيز المواد المتفاعلة مع درجة الحرارة.
ب- تركيز المواد الناتجة مع درجة الحرارة.
ج- سرعة التفاعل مع الزمن.
د- تركيز المواد المتفاعلة أو الناتجة مع الزمن.
- يبين الجدول المجاور بيانات تفاعل افتراضي: نواتج →A + B ، عند درجة حرارة معينة:
ادرس المعلومات الواردة فيه ثم أجب عن الفقرات (4، 5، 6، 7)

4- قانون سرعة التفاعل هو:
أ- R = k [A]1 [B]1
ب- R = k [A]1
ج- R = k [A]2 [B]1
د- R = k [B]1
5- قيمة ثابت سرعة هذا التفاعل k تساوي:
أ- 1
ب- 0.1
ج- 0.01
د- 0.001
6- سرعة التفاعل (M.s-1) عندما يكون [A] = 0.5 M = [B] ، تساوي:
أ- 5 x 10-3
ب- 0.5 x 10-3
ج- 3.3 x 10-5
د- 0.3 x 10-5
7- زيادة تركيز المادة B مع بقاء تركيز المادة A ثابت، فإن سرعة التفاعل بمرور الزمن:
أ- تزداد.
ب- تقل.
ج- لا تتأثر.
د- تساوي ثابت سرعة التفاعل.
8- العبارة الصحيحة من العبارات الآتية:
أ- التصادم بين جسيمات المواد المتفاعلة شرط كافٍ لحدوث التفاعل الكيميائي.
ب- يحدث التفاعل الكيميائي عندما يكون التصادم بين جسيمات المواد المتفاعلة تصادماً فعالاً.
ج- في التفاعل الطارد للطاقة تكون طاقة المواد الناتجة أكبر من طاقة المواد المتفاعلة.
د- في التفاعل الماص للطاقة تكون طاقة التنشيط للتفاعل العكسي أكبر من طاقة التنشيط للتفاعل الأمامي.
- الجدول الآتي فيه معلومات للتفاعل الافتراضي: F + C 2D → عند درجة حرارة معينة، ادرسه ثم أجب عن الفقرتين (9، 10)، علماً بأن التفاعل من الرتبة الأولى:
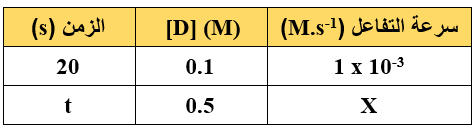
9- قيمة الزمن (t):
أ- أكبر من 20 s
ب- أقل من 20 s
ج- تساوي 20 s
د- أكبر من 30 s
10- العبارة الصحيحة المتعلقة بقيمة (X)، هي:
أ- أكبر من 1 x 10-3
ب- أقل من 1 x 10-3
ج- تساوي 1 x 10-3
د- تساوي 2 x 10-4
- في التفاعل الافتراضي: + 30KJ A + B → 2AB ، عند درجة حرارة معينة، إذا كانت طاقة المواد الناتجة = 50 kJ ، وطاقة المعقد المنشط = 110 kJ، أجب عن الفقرات (11، 12، 13):
11- قيمة طاقة التنشيط للتفاعل العكسي (kJ)، تساوي:
أ- 20
ب- 40
ج- 60
د- 80
12- قيمة طاقة التنشيط للتفاعل الأمامي (kJ)، تساوي:
أ- 60
ب- 50
ج- 40
د- 30
13- قيمة طاقة المواد المتفاعلة (kJ)، تساوي:
أ- 80
ب- 70
ج- 60
د- 40
- في التفاعل الافتراضي: 2AB + 50KJ → A2 + B2 ،إذا علمت أن طاقة التنشيط للتفاعل الأمامي = (100 kJ) وطاقة المعقد المنشط = (200 kJ)، وعند إضافة عامل مساعد تغيرت قيمة طاقة التنشيط للتفاعل العكسي بمقدار (10 kJ)، أجب عن الفقرات (14، 15، 16):
14- طاقة المواد الناتجة (kJ)، تساوي:
أ- 150
ب- 120
ج- 110
د- 90
15- طاقة التنشيط للتفاعل العكسي (kJ) بوجود العامل المساعد، تساوي:
أ- 60
ب- 50
ج- 40
د- 30
16- طاقة المعقد المنشط (kJ) بوجود العامل المساعد، تساوي:
أ- 210
ب- 190
ج- 180
د- 150
إعداد : شبكة منهاجي التعليمية
21 / 04 / 2023
النقاشات