إجابات أسئلة مراجعة الدرس الأول
سرعة التفاعلات الكيميائية
السؤال الأول:
الفكرة الرئيسة:
أوضّح كيفية حساب سرعة التفاعل المتوسطة والسرعة الابتدائية من الرسم البياني.
لحساب سرعة التفاعل المتوسطة أرسم منحنى السرعة؛ الذي يبين التغير في كمية مادة متفاعلة أو مادة ناتجة خلال مدة زمنية محددة، ثم أقسم التغير الكالي في كمية المادة على الزمن المستغرق في ذلك.
لحساب سرعة التفاعل الابتدائية أرسم منحنى السرعة؛ الذي يبين التغير في كمية مادة متفاعلة أو مادة ناتجة خلال مدة زمنية محددة، ثم أجد ميل المماس عند النقطة التي تمثل كمية المادة المتفاعلة أو الناتجة عن الزمن صفر.
السؤال الثاني:
أوضح المقصود بكل من: سرعة التفاعل، السرعة اللحظية للتفاعل.
سرعة التفاعل: التغير في كمية مادة متفاعلة أو مادة ناتجة خلال مدة زمنية محددة.
السرعة اللحظية للتفاعل: سرعة التفاعل عند أي لحظة معينة.
السؤال الثالث:
أحسب سرعة تكوين غاز الأمونيا NH3 علماً أنّ سرعة استهلاك غاز النيتروجين 0.5 M/s وفق معادلة التفاعل الموزونة الآتية:
N2(g) + 3H2(g) 2NH3(g)
R = - =
R = 0.5 M/s =
= 1 M/s
السؤال الرابع:
أحسب سرعة تكوين المادة A في المدة الزمنية 3 s – 6 s
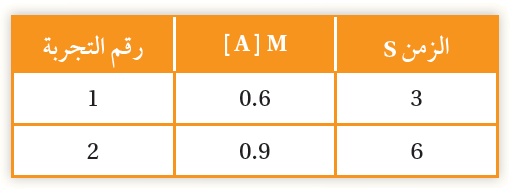
R = = = = 0.1 M/s
السؤال الخامس:
أحسب باستخدام الرسم البياني الآتي السرعة اللحظية عند الزمن 40 s :
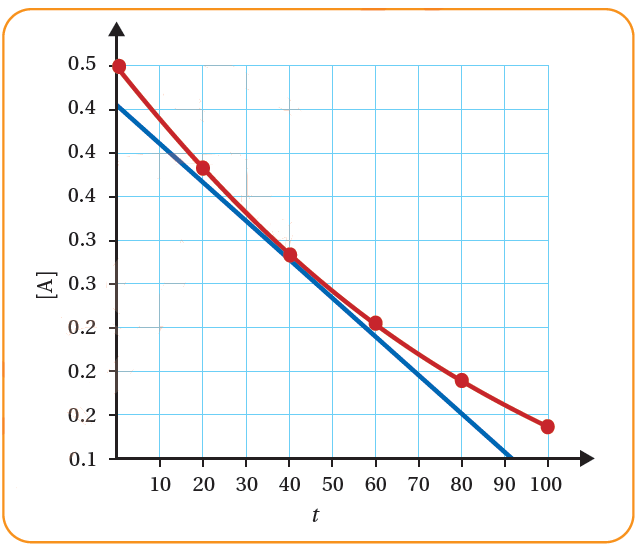
G = = ≈ 0.009 M/s
إعداد : شبكة منهاجي التعليمية
22 / 06 / 2023
النقاشات