أسئلة مراجعة الوحدة الأولى
أشكال الجزيئات وقوى التجاذب في ما بينها
السؤال الأول:
أوضح المقصود بكلّ من المفاهيم الآتية:
الرابطة التناسقية، الفلك المهجن، قوى التجاذب ثنائية القطب.
السؤال الثاني:
أتوقع الشكل الفراغي لكلّ من الجزيئات الآتية، بالاعتماد على تراكيب لويس لكلّ منها:
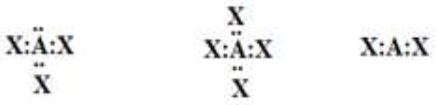
السؤال الثالث:
أقارن بين الجزيئين BH3 , NH3 ، من حيث:
عدد أزواج الإلكترونات حول الذرة المركزية، عدد أزواج الإلكترونات غير الرابطة، نوع التهجين في الذرة المركزية، الشكل الفراغي، الزاوية بين الروابط، قطبية الجزيئات.
السؤال الرابع:
أجيب عمّا يأتي في ما يتعلق بالجزيء BeF2 . علماً بأن العدد الذري للبريليوم (4):
أ- أكتب التوزيع الإلكتروني لذرة البريليوم (Be) قبل التهجين وبعده.
ب- أحدد نوع التهجين في الذرة المركزية Be .
ج- أحدد نوع الأفلاك المكونة للرابطة Be-F .
د- أتوقع مقدار الزاوية بين الروابط (الأفلاك المهجنة) في الجزيء BeF2 .
هـ- أرسم الشكل البنائي للجزيء وأسمّيه.
السؤال الخامس:
عنصران (Y , X) من الدورة الثانية، يكوّنان مع الفلور الصيغتين (YF2 , XF2) على التوالي.
إذا كان المركب XF2 يمتلك أزواج إلكترونات غير رابطة، فأجيب عن الأسئلة الآتية:
أ- أكتب تركيب لويس لكلّ من المركبين.
ب- أحدد العدد الذري لكلّ من X و Y .
ج- أحدد نوع الأفلاك التي تستخدمها كل من الذرتين في تكوين الروابط.
د- أرسم الشكل الفراغي لكل من XF2 و YF2 ، وأحدد قطبية كلّ منهما.
هـ- أتوقع مقدار الزاوية بين الروابط في كل من المركبين.
السؤال السادس:
أرسم الأشكال الفراغية لكل من الجزيئات الآتية، وأبين قطبية كلّ منها:
NF3 , BCl3 , OCl2 , CH2Cl2 , BeH2
السؤال السابع:
أفسّر:
أ- درجة غليان المركب CH3CH2Cl أعلى منها للمركب CH3CH3 .
ب- درجة غليان المركب NH2CH2CH2NH2 أعلى منها للمركب CH3CH2CH2NH2 .
ج- الجزيء CHCl3 قطبي، بينما الجزيء CCl4 غير قطبي.
د- الرابطة (B-F) قطبية، بينما الجزيء BF3 غير قطبي.
هـ- يذوب الإيثانول C2H5OH في الماء، بينما الإيثان C2H6 لا يذوب.
السؤال الثامن:
أنظم جدولاً، أقارن فيه بين الجزيئات PCl3 و H2O و CO2 و GeCl4
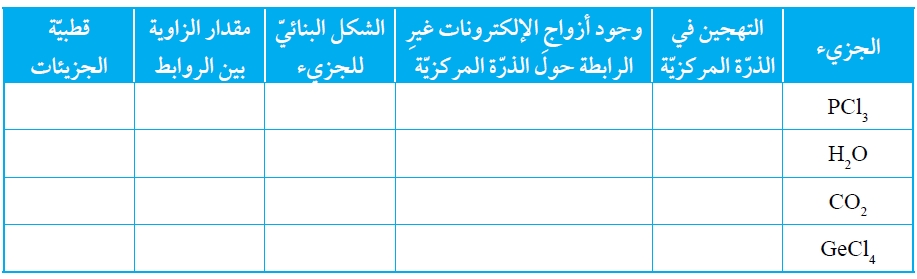
السؤال التاسع:
الإيثين مركب عضوي صيغته C2H4 ، يعرف باسم الإيثيلين يستخدم في صناعة المبلمرات البلاستيكية. إذا كان العدد الذري للكربون (6)، فأرسم تركيب لويس للجزيء، ثم:
أ- أحدد عدد الروابط سيجما () وباي () في الجزيء.
ب- أبين نوع التهجين الذي تستخدمه ذرة الكربون.
ج- أوضح توزيع أزواج الإلكترونات في الفراغ حول ذرة الكربون.
د- أحدد مقدار الزاوية بين الروابط حول كل ذرة كربون.
السؤال العاشر:
أدرس الجدول الآتي، ثم أجيب عن الأسئلة الآتية:
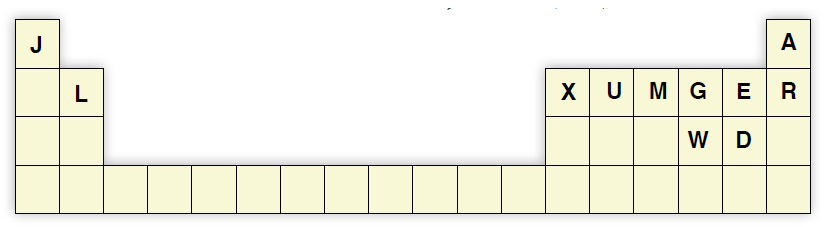
أ- أكتب تركيب لويس لكل من: B, C, U, M
ب- أكتب تركيب لويس للجزيئات: CE3, GD2
ج- أتوقع الشكل الفراغي لكل من المركبات: BE2, CD3, ME3, UD4
د- أحدد الجزيء القطبي بين الجزيئات: GD2, CD3, UD4, BE2
هـ- أحدد نوع تهجين الذرة المركزية لكل من الجزيئات: BE2, CD3, ME3, UD4, GD2
و- أحدد مقدار الزاوية بين الروابط في كل من الجزيئات: CD3, ME3, GD2
ز- أحدد الجزيئات القطبية بين الجزيئات: BE2, CD3, ME3, UD4, GD2
ح- أقارن بالرسم قطبية الجزيء MH3 بالجزيء ME3
ط- أحدد المادة الأعلى درجة غليان في الحالة السائلة A أم R ، وأسوّغ ذلك.
السؤال الحادي عشر:
يبين الشكل المجاور تغير درجة غليان بعض مركبات عناصر المجموعة السادسة وفق ترتيبها في الجدول الدوري. أدرسها، ثم أجيب عمّا يأتي:
أ- أحدد نوع قوى التجاذب في كل مركب منها.
ب- أفسر الاختلاف الكبير في درجة غليان الماء مقارنة بباقي مركبات عناصر المجموعة.
ج- أفسر تزايد درجة غليان مركبات عناصر المجموعة بزيادة رقم دورتها في الجدول الدوري.
السؤال الثاني عشر:
أختار الإجابة الصحيحة لكل فقرة في ما يأتي:
1) العبارة غير الصحيحة في ما يتعلق بالأفلاك المهجنة، هي:
أ- متماثلة في الطاقة.
ب- متماثلة في الشكل.
ج- متماثلة في الاتجاه الفراغي.
د- متماثلة في السعة.
2) الشكل البنائي المرتبط بالتهجين sp2 ، هو:
أ- رباعي الأوجه منتظم.
ب- هرم ثلاثي.
ج- مثلث مستوٍ.
د- خطي.
3) المركب الذي يتخذ الشكل رباعي الأوجه منتظم في ما يأتي، هو:
أ- SiCl4
ب- BeF2
ج- OCl2
د- NF3
4) عدد الروابط سيجما وباي في الجزيء CH3CH=CH2 ، هو:
أ- (8) سيجما و (2) باي.
ب- (9) سيجما و (1) باي.
ج- (8) سيجما و (1) باي.
د- (9) سيجما و (2) باي.
5) تتكون الرابطة (H - C) في الجزيء CH4 من تداخل الأفلاك:
أ- s - p
ب- p - p
ج- s - sp3
د- sp3 - sp3
6) الشكل الفراغي الذي تكون فيه الزاوية بين الروابط 120o ، هو:
أ- هرم ثلاثي.
ب- مثلث مستوٍ.
ج- منحنٍ.
د- رباعي الأوجه منتظم.
7) الجزيئات التي تنشأ بينها قوى تجاذب ثنائي القطب في الحالة السائلة:
أ- SiCl4
ب- BH3
ج- OCl2
د- NH3
8) المادة التي تترابط جزيئاتها بقوى الترابط الهيدروجيني:
أ- CH3F
ب- CH3OH
ج- HCl
د- CH3OCH3
9) الترتيب الصحيح للمواد الآتية حسب قوى الترابط بين جزيئاتها:
أ- BCl3 < BF2Cl < HF < NH3
ب- BF2Cl < BCl3 < HF < NH3
ج- BF2Cl < BCl3 < NH3 < HF
د- BCl3 < BF2Cl < NH3 < HF
10) المادة الأكثر ترابطاً في الحالة السائلة من بين المواد الآتية:
أ- CHCl3
ب- BF3
ج- NH3
د- CH3OCH3
إعداد : شبكة منهاجي التعليمية
03 / 07 / 2024
النقاشات