ثابت الاتزان
Equilibrium Constant
عند وصول التفاعل إلى حالة الاتزان:
- يستمر التفاعل بالاتجاهين الأمامي والعكسي.
- تكون سرعة التفاعل الأمامي تساوي سرعة التفاعل العكسي.
- تبقى تراكيز المواد الناتجة والمتفاعلة ثابتة.
تعبير ثابت الاتزان
توصل العالمان كاتو جولدبيرج وبيتر وييج عند دراسة التفاعلات المتزنة إلى قانون فعل الكتلة.
نصق قانون فعل الكتلة
عند درجة حرارة معينة يصل التفاعل إلى حالة تكون عندها نسبة تراكيز المواد المتفاعلة إلى تراكيز المواد الناتجة مرفوعاً كل منها إلى قوة تساوي معاملاتها، قيمة ثابتة ثابت الاتزان.
ثابت الاتزان: تعبير يمثل نسبة تراكيز المواد الناتجة إلى تراكيز المواد المتفاعلة مرفوعاً كلّ منها إلى قوة تساوي معاملاتها في المعادلة الموزونة.
فمثلاً، إذا كان لديك التفاعل الافتراضي الآتي:
aA + bB cC + dD
يعبر عن ثابت الاتزان (Keq) على النحو الآتي:
Keq =
ويمثل البسط والمقام في ثابت الاتزان التركيز المولاري لكل منهما، ويمكن اختصار ثابت الاتزان بالرمز (Kc).
Kc =
مثال:
تصنع الأمونيا بطريقة هابر عن طريق تفاعل الهيدروجين مع النيتروجين، وفق المعادلة:
N2(g) + 3H2(g) 2NH3(g)
يعبر عن ثابت الاتزان لتفاعل تحضير الأمونيا على النحو الآتي:
Kc =
وإذا كانت جميع متفاعلات ونواتج التفاعل في الحالة الغازية، يمكن التعبير عن ثابت الاتزان بدلالة الضغوط الجزئية للغازات بدلاً من التراكيز، ويرمز لثابت الاتزان في هذه الحالة بالرمز (Kp):
Kp =
أهمية ثابت الاتزان
يستفاد من قيمة ثابت الاتزان في كل من:
- حساب كميات المواد المتفاعلة والناتجة عن الاتزان.
- تحديد الجهة التي يرجحها الاتزان؛ فإذا كانت قيمة:
- (Kc>1)؛ يكون موضع الاتزان مُزاحاً إلى جهة المواد الناتجة، ويكون تراكيز المواد الناتجة أكبر من المتفاعلات، ويكون مردود التفاعل أكبر.
- (Kc<1)؛ يكون موضع الاتزان مُزاحاً إلى جهة المواد المتفاعلة، ويكون تراكيز المواد المتفاعلات أكبر من النواتج، ويكون مردود التفاعل أقل.

الاتزان المتجانس
الاتزان المتجانس: حالة الاتزان التي تكون فيها المواد المتفاعلة والناتجة جميعها في الحالات الفيزيائية نفسها سواء أكانت غازات أم محاليل.
يعبر عن ثابت الاتزان لهذه التفاعلات بدلالة تراكيز المواد كلها في التفاعل.
مثال:
4NH3(g) + 7O2(g) 4NO2(g) + 6H2O(g)
ويكون تعبير ثابت الاتزان على النحو الآتي:
Kc =
الاتزان غير المتجانس
الاتزان غير المتجانس: حالة الاتزان التي تكون فيها المواد المتفاعلة والناتجة في حالة فيزيائية متنوعة (صلبة، أو سائلة، أو غازية).
يعبر عن ثابت الاتزان لهذه التفاعلات بدلالة تراكيز المواد كلها في التفاعل، باستثناء المواد الصلبة والسائلة كالماء؛ لأن تراكيزها تبقى ثابتة، ولا تكتب في تعبير ثابت الاتزان.
مثال (1):
CaCO3(s) CaO(s) + CO2(g)
ويكون تعبير ثابت الاتزان على النحو الآتي:
Kc = [CO2]1
مثال (2):
أكتب تعبير ثابت الاتزان بدلالة التركيز للتفاعل الآتي:
2H2O(l) 2H2(g) + O2(g)
يكون تعبير ثابت الاتزان على النحو الآتي:
Kc = [H2]2 [O2]1
مثال (3):
أكتب تعبير ثابت الاتزان بدلالة التركيز للتفاعل الآتي:
Cu(s) + 2Ag(aq) Cu2+(aq) + 2Ag(s)
باستبعاد المواد الصلبة، يكتب تعبير ثابت الاتزان على النحو الآتي:
Kc =
سؤال:
أكتب تعبير ثابت الاتزان بدلالة التركيز للتفاعلات الآتية:
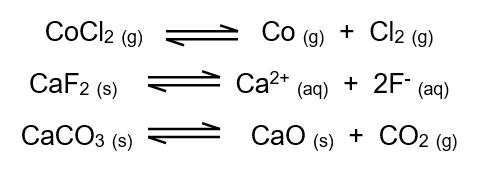
الحل:
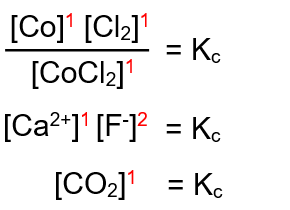
إعداد : أ. أحمد الحسين
26 / 10 / 2025
النقاشات