يحتاج نزع الإلكترونات من الذرة إلى طاقة، نظراً لقوة الترابط بين البروتونات والإلكترونات، تُعرف هذه الطاقة بطاقة التأين.
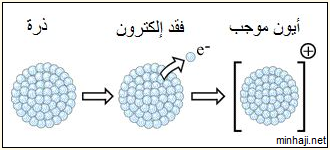
طاقة التأين: الطاقة اللازمة لنزع الإلكترون الأبعد عن النواة (الأقل ارتباطاً بالنواة) من الذرّة المفردة، وهي في الحالة الغازية.
ويمكن التعبير عن العملية كما يلي:
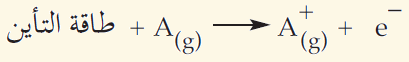
حيث A يمثل أي عنصر في الحالة الغازية.
مثال:
عند نزع إلكترون من ذرة صوديوم، تحتاج ذرة الصوديوم إلى طاقة تأين (مقدارها 496 kj/mol ) لتتحول إلى أيون الصوديوم الموجب:
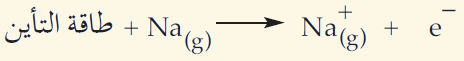
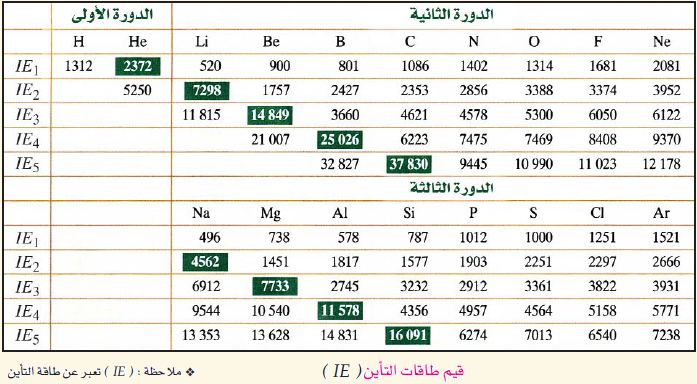
دورية طاقة التأين
لاحظ كيف تتغير قيم طاقات التأين لعناصر المجموعات الرئيسة في الجدول الدوري، عبر الدورة الواحدة، والمجموعة الواحدة.
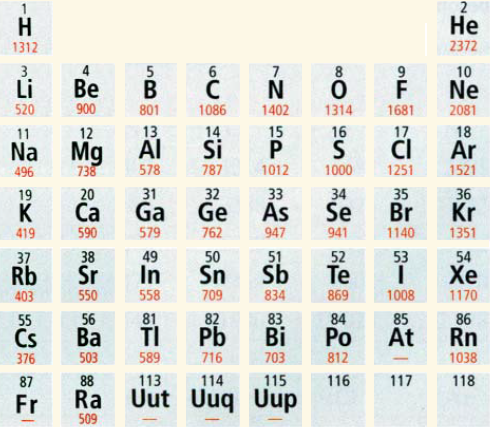
بعد مشاهدتك للجدول لعلك لاحظت أن:
· تزداد قيم طاقات التأين في الدورة الواحدة بزيادة العدد الذري (بالاتجاه من اليسار إلى اليمين).
· تقل قيم طاقات التأين في المجموعة الواحدة بزيادة العدد الذري (بالاتجاه من الأعلى إلى الأسفل).
· أعلى قيمة لطاقات التأين لعناصر الدورة الواحدة هي للعنصر النبيل الذي يقع في نهاية كلّ دورة، لأن توزيعه الإلكتروني أكثر استقراراً من غيره، فيصعب نزع إلكترون من ذرته، كما أن حجمه الذري أصغر مقارنة مع عناصر دورته.
· طاقات التأين للعناصر اللافلزية أكبر نسبياً مقارنة مع العناصر الفلزية، وذلك لأن العناصر اللافلزية تميل إلى كسب الإلكترونات حتى تصل إلى حالة الاستقرار.
وتعتمد طاقة التأين للعنصر على الحجم الذري، فالذرة ذات الحجم الأقل يصعب نزع إلكترون من ذرتها لقوة ارتباطه بالنواة، لذا تزداد طاقة تأينها.
للعنصر الواحد أكثر من طاقة تأين
للعنصر الوحد أكثر من طاقة تأين، فعند نزع إلكترون من الذرة المتعادلة تحتاج الذرة إلى طاقة تسمى طاقة التأين الأولى، وينتج عن ذلك أيون ذو شحنة موجبة واحدة.
وعند نزع إلكترون من الأيون ذو الشحنة الأحادية الموجبة، يحتاج الأيون إلى طاقة أخرى تُسمّىطاقة التأين الثاني، وينتج عن ذلك أيون ذو شحنة ثنائية موجبة، وهكذا ...
الجدول التالي يمثل قيم طاقات التأين لعناصر مختلفة.
سؤال:
فسّر: طاقة التأين الثانية للعنصر أكبر من طاقة التأين الأولى له.
الجواب:
عند نزع إلكترون من الذرة يقل حجمها، فتزداد قوة ارتباط إلكترونات المدار الأخير بالنواة فتزداد طاقة التأين.
إعداد : شبكة منهاجي التعليمية
14 / 11 / 2017
النقاشات