إجابات أسئلة مراجعة الوحدة الأولى
أشكال الجزيئات وقوى التجاذب بينها
السؤال الأول:
أوضح المقصود بكلّ من المفاهيم الآتية:
الرابطة التناسقية، الفلك المهجن، قوى التجاذب ثنائية القطب.
الرابطة التناسقية: أحد أنواع الروابط التساهمية، ينشأ نتيجة مشاركة إحدى الذرتين بزوج من الإلكترونات، في حين تشارك الذرة الأخرى بفلك فارغ.
الأفلاك المهجنة: أفلاك جديدة تنتج من اندماج أفلاك الذرة نفسها، تختلف عنها في الشكل والطاقة وتشارك في تكوين الروابط.
قوى التجاذب ثنائية القطب: قوى تجاذب ضعيفة نسبياً تربط جزيئات المادة القطبية نتيجة لوجود محصلة لاستقطاب الروابط.
السؤال الثاني:
أتوقع الشكل الفراغي لكلّ من الجزيئات الآتية، بالاعتماد على تراكيب لويس لكلّ منها:
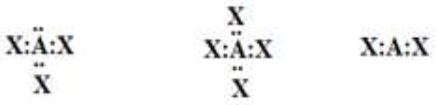
خطي، رباعي الأوجه منتظم، هرم ثلاثي.
السؤال الثالث:
أقارن بين الجزيئين BH3 , NH3 ، من حيث:
عدد أزواج الإلكترونات حول الذرة المركزية، عدد أزواج الإلكترونات غير الرابطة، نوع التهجين في الذرة المركزية، الشكل الفراغي، الزاوية بين الروابط، قطبية الجزيئات.
|
وجه المقارنة |
NH3 |
BH3 |
|
عدد أزواج الإلكترونات حول الذرة المركزية |
4 |
3 |
|
عدد أزواج الإلكترونات غير الرابطة |
1 |
0 |
|
نوع التهجين في الذرة المركزية |
sp3 |
sp2 |
|
الشكل الفراغي |
هرم ثلاثي |
مثلث مستو |
|
الزاوية بين الروابط |
107o |
120o |
|
قطبية الجزيئات |
قطبي |
غير قطبي |
السؤال الرابع:
أجيب عمّا يأتي في ما يتعلق بالجزيء BeF2 . علماً أن العدد الذري للبريليوم (4):
أ- أكتب التوزيع الإلكتروني لذرة البريليوم (Be) قبل التهجين وبعده.
قبل التهجين: 1s2 2s2 2p0 ، بعد التهجين: 1s2 2sp1 2sp1
ب- أحدد نوع التهجين في الذرة المركزية Be .
sp
ج- أحدد نوع الأفلاك المكونة للرابطة Be-F .
sp - s
د- أتوقع مقدار الزاوية بين الروابط (الأفلاك المهجنة) في الجزيء BeF2 .
1800
هـ- أرسم الشكل البنائي للجزيء وأسمّيه.
F – Be - F خطي.
السؤال الخامس:
عنصران (Y , X) من الدورة الثانية، يكوّنان مع الفلور الصيغتين (YF2 , XF2) على التوالي.
إذا كان المركب XF2 يمتلك أزواج إلكترونات غير رابطة، فأجيب عن الأسئلة الآتية:
أ- أكتب تركيب لويس لكلّ من المركبين.

ب- أحدد العدد الذري لكلّ من X و Y .
العدد الذري للعنصر (X) هو (8)، وللعنصر (Y) هو (4).
ج- أحدد نوع الأفلاك التي تستخدمها كل من الذرتين في تكوين الروابط.
جزي (XF2) نوع الأفلاك:sp3 ، وفي جزيء (YF2) نوع الأفلاك: sp2
د- أرسم الشكل الفراغي لكل من XF2 و YF2 ، وأحدد قطبية كلّ منهما.
الجزي (XF2): منحنٍ(قطبي)، والجزيء (YF2): خطي (غير قطبي).
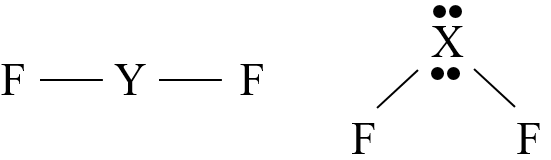
هـ- أتوقع مقدار الزاوية بين الروابط في كل من المركبين.
الزاوية في الجزي (XF2):104.5 ، والجزيء (YF2): 180
السؤال السادس:
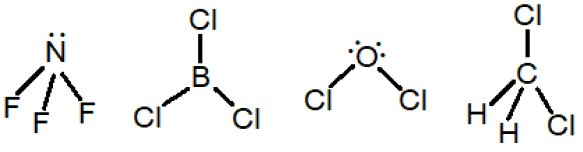
أرسم الأشكال الفراغية لكل من الجزيئات الآتية، وأبين قطبية كلّ منها:
NF3 , BCl3 , OCl2 , CH2Cl2 , BeH2
جزي BeH2 : خطي (غير قطبي).
جزي CH2Cl2 : رباعي الأوجه منتظم (غير قطبي).
جزي OCl2 : منحنٍ (قطبي).
جزي BCl3 : مثلث مستوٍ (غير قطبي).
جزي NF3 : هرم ثلاثي (قطبي).
السؤال السابع:
أفسّر:
أ- درجة غليان المركب CH3CH2Cl أعلى منها للمركب CH3CH3 .
ترتبط جزيئات CH3CH2Cl بقوى ترابط ثنائية القطب، بينما ترتبط جزيئات CH3CH3 بقوى لندن، وبذلك فإن الطاقة اللازمة للتغلب على قوى التجاذب بين جزيئات CH3CH2Cl أعلى مما يلزم لجزيئات، وبذلك فإن درجة غليانه تكون أعلى.
ب- درجة غليان المركب NH2CH2CH2NH2 أعلى منها للمركب CH3CH2CH2NH2 .
يحتوي المركب NH2CH2CH2NH2 على مجموعتي (NH2) يمكنه تكوين مجموعتين من الروابط الهيدروجينية، ويكون التجاذب بين جزيئاته أكبر من المركب CH3CH2CH2NH2 الذي يحتوي مجموعة واحدة من (NH2) ويكوّن مجموعة واحدة من الروابط الهيدروجينية.
ج- الجزيء CHCl3 قطبي، بينما الجزيء CCl4 غير قطبي.
محصلة قطبية الروابط في الجزيء (CHCl3) لا تساوي صفر، بينما محصلة قطبية الروابط في الجزيء (CCl4) تساوي صفر.
قطبية الروابط في الجزيء (CCl4) تلغي بعضها بعضاً فيكون الجزيء غير قطبي، في حين أن قطبية الروابط في الجزيء (CHCl3) لا تلغي بعضها فيكون الجزيء قطبي.
د- الرابطة (B-F) قطبية، بينما الجزيء BF3 غير قطبي.
الرابطة (B-F) قطبية لوجود فرق في السالبية الكهربائية بين ذرتي البورون والفلور، بينما الجزيء (BF3) غير قطبي لأن محصلة قطبية الروابط تساوي صفر، فقطبية الروابط تلغي بعضها بعضاً.
هـ- يذوب الإيثانول C2H5OH في الماء، بينما الإيثان C2H6 عديم الذوبان.
جزيئات الإيثانول قطبية ترتبط فيما بينها بروابط هيدروجينية، وكذلك الماء جزيئاته قطبية وترتبط فيما بينها بروابط هيدروجينية، مما يسبب حدوث روابط هيدروجينية بين جزيئات الماء وجزيئات الإيثانول؛ ما يساعد على ذوبان الإيثانول، في حين أن جزيئات الإيثان غير قطبية، ما يقلل من انجذابها نحو جزيئات الماء، وبذلك يكون عديم الذوبان.
السؤال الثامن:
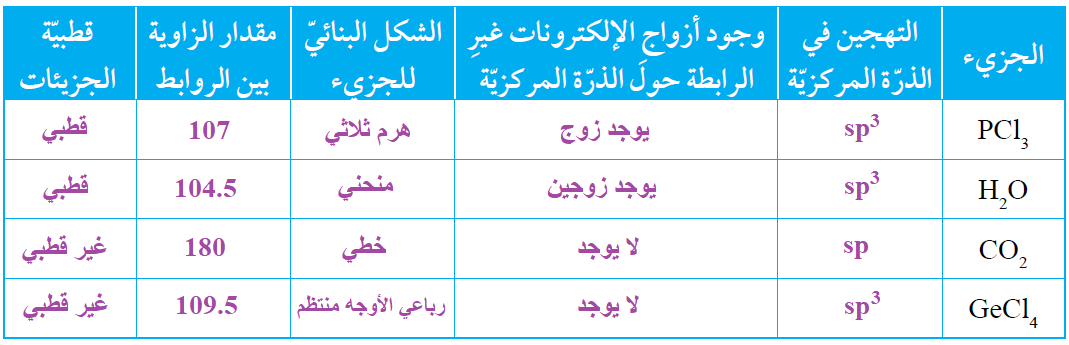
أنظم جدولاً، أقارن فيه بين الجزيئات PCl3 و H2O و CO2 و GeCl4
السؤال التاسع:
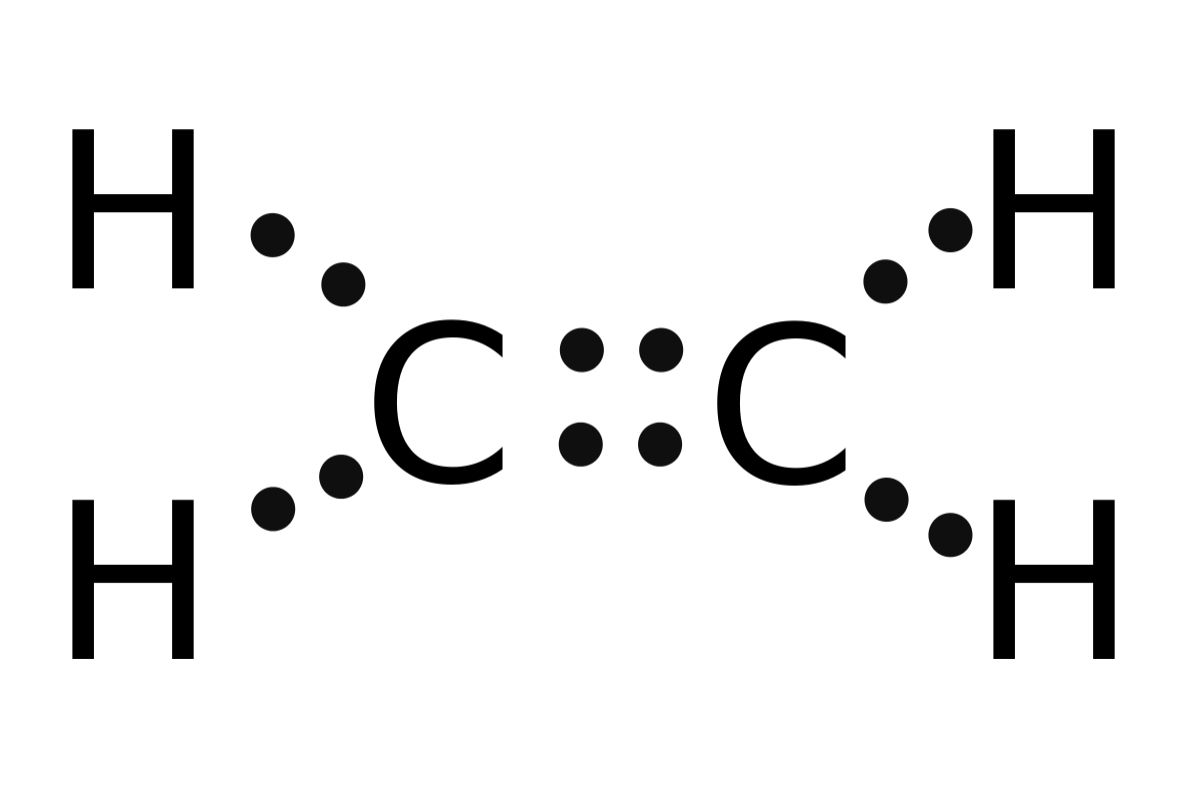 الإيثين مركب عضوي صيغته C2H4 ، يعرف باسم الإيثيلين يستخدم في صناعة المبلمرات البلاستيكية. إذا كان العدد الذري للكربون (6)، فأرسم تركيب لويس للجزيء، ثم:
الإيثين مركب عضوي صيغته C2H4 ، يعرف باسم الإيثيلين يستخدم في صناعة المبلمرات البلاستيكية. إذا كان العدد الذري للكربون (6)، فأرسم تركيب لويس للجزيء، ثم:
أ- أحدد عدد الروابط سيجما () وباي () في الجزيء.
عدد روابط سيجما (5)، وعدد روابط باي (1).
ب- أبين نوع التهجين الذي تستخدمه ذرة الكربون.
sp2
ج- أوضح توزيع أزواج الإلكترونات في الفراغ حول ذرة الكربون.
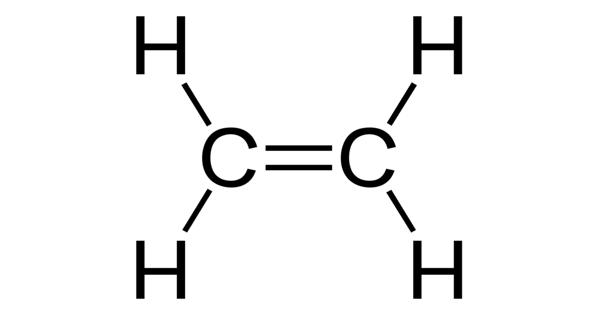
د- أحدد مقدار الزاوية بين الروابط حول كل ذرة كربون.
1200
السؤال العاشر:
أدرس الجدول الآتي، ثم أجيب عن الأسئلة الآتية:
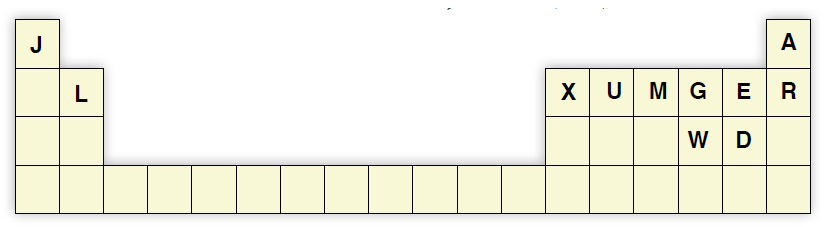
أ- أكتب تركيب لويس لكل من: L, X, U, M

ب- أكتب تركيب لويس للجزيئات: XE3, GD2

ج- أتوقع الشكل الفراغي لكل من المركبات: LE2, XD3, ME3, UD4
UD4 : رباعي الأوجه منتظم، ME3 : هرم ثلاثي، XD3 : مثلث مستوٍ، LE2 : خطي.
د- أحدد الجزيء القطبي بين الجزيئات: GD2, XD3, UD4, LE2
الجزيء القطبي: GD2
هـ- أحدد نوع تهجين الذرة المركزية لكل من الجزيئات: LE2, XD3, ME3, UD4, GD2
GD2 : sp3، UD4 : sp3، ME3 : sp3، XD3 : sp2، LE2 : sp
و- أحدد مقدار الزاوية بين الروابط في كل من الجزيئات: XD3, ME3, GD2
GD2 : 104.5، ME3 : 107، XD3 : 120
ز- أحدد الجزيئات القطبية بين الجزيئات: LE2, XD3, ME3, UD4, GD2
الجزيئات القطبية: ME3, GD2
ح- أقارن بالرسم قطبية الجزيء MJ3 بالجزيء ME3
قطبية الجزيء MJ3 أكبر من قطبية الجزيء ME3 .
ط- أحدد المادة الأعلى درجة غليان في الحالة السائلة A أم R ، وأفسّر ذلك.
المادة الأعلى درجة غليان في الحالة السائلة هي R ؛ لأن عدده الذري أكبر؛ وبذلك فإنه يحتوي عدد أكبر من الإلكترونات، وكذلك كتلته الذرية أكبر، وتكون قوى لندن بين ذراته أقوى؛ لذلك تكون درجة غليانه أعلى.
السؤال الحادي عشر:
يبين الشكل المجاور تغير درجة غليان بعض مركبات عناصر المجموعة السادسة وفق ترتيبها في الجدول الدوري. أدرسها، ثم أجيب عمّا يأتي:
أ- أحدد نوع قوى التجاذب في كل مركب منها.
جزيء H2O : روابط هيدروجينية، والبقية قوى ثنائية القطب.
ب- أفسر الاختلاف الكبير في درجة غليان الماء مقارنة بباقي مركبات عناصر المجموعة.
بسبب ترابط جزيئات الماء بروابط هيدروجينية الأقوى من قوى ثنائية القطب التي تربط الجزيئات الأخرى.
ج- أفسر تزايد درجة غليان مركبات عناصر المجموعة بزيادة رقم دورتها في الجدول الدوري.
تزداد درجة غليان مركبات عناصر المجموعة باستثناء الماء بسبب زيادة كتلها المولية؛ ما يزيد قوى ثنائية القطب بينها فتزداد درجة غليانها.
السؤال الثاني عشر:
أختار الإجابة الصحيحة لكل فقرة في ما يأتي:
1) العبارة غير الصحيحة في ما يتعلق بالأفلاك المهجنة، هي:
أ- متماثلة في الطاقة.
ب- متماثلة في الشكل.
ج- متماثلة في الاتجاه الفراغي.
د- متماثلة في السعة.
2) الشكل البنائي المرتبط بالتهجين sp2 ، هو:
أ- رباعي الأوجه منتظم.
ب- هرم ثلاثي.
ج- مثلث مستوٍ.
د- خطي.
3) المركب الذي يتخذ الشكل رباعي الأوجه منتظم في ما يأتي، هو:
أ- SiCl4
ب- BeF2
ج- OCl2
د- NF3
4) عدد الروابط سيجما وباي في الجزيء CH3CH=CH2 ، هو:
أ- (8) سيجما و (2) باي.
ب- (9) سيجما و (1) باي.
ج- (8) سيجما و (1) باي.
د- (9) سيجما و (2) باي.
5) تتكون الرابطة (H - C) في الجزيء CH4 من تداخل الأفلاك:
أ- s - p
ب- p - p
ج- s - sp3
د- sp3 - sp3
6) الشكل الفراغي الذي الذي تكون فيه الزاوية بين الروابط 120o ، هو:
أ- هرم ثلاثي.
ب- مثلث مستوٍ.
ج- منحنٍ.
د- رباعي الأوجه منتظم.
7) الجزيئات التي تنشأ بينها قوى تجاذب ثنائي القطب في الحالة السائلة:
أ- SiCl4
ب- BH3
ج- OCl2
د- NH3
8) المادة التي تترابط جزيئاتها بروابط هيدروجينية:
أ- CH3F
ب- CH3OH
ج- HCl
د- CH3OCH3
9) الترتيب الصحيح للمواد الآتية حسب قوى الترابط بين جزيئاتها:
أ- BCl3 < BF2Cl < HF < NH3
ب- BF2Cl < BCl3 < HF < NH3
ج- BF2Cl < BCl3 < NH3 < HF
د- BCl3 < BF2Cl < NH3 < HF
10) المادة الأكثر ترابطاً في الحالة السائلة من بين المواد الآتية:
أ- CHCl3
ب- BF3
ج- NH3
د- CH3OCH3
إعداد : شبكة منهاجي التعليمية
04 / 07 / 2024
النقاشات