المحاليل السائلة
محلول غاز في سائل
تعتمد ذائبية الغازات في الماء على ثلاثة عوامل، هما:
1- طبيعة الغاز
ذائبية العديد من الغازات منخفضة في الماء، وتزداد بزيادة الكتلة المولية للغاز؛ ويعود ذلك إلى زيادة قوى التجاذب بين جسيمات الغاز زجزيئات الماء.
2- درجة الحرارة
بزيادة درجة الحرارة تقل ذائبية الغازات في الماء؛ إذ تزداد الطاقة الحركية لجسيمات الغاز وتتغلب على قوى التجاذب بينها وبين جزيئات الماء؛ ما يؤدي إلى انفلاتها ومغادرتها المحلول.
المنحنى الآتي يمثل أثر ذائبية بعض الغازات في الماء:
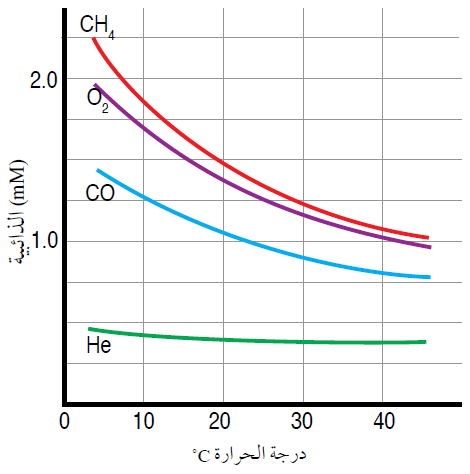
من المنحنى يمكن ملاحظة ما يلي:
- ذائبية الغازات منخفضة في الماء.
- تقل ذائبية الغاز بزيادة درجة الحرارة، فبزيادة الكتلة المولية تقل ذائبية الغاز في الماء.
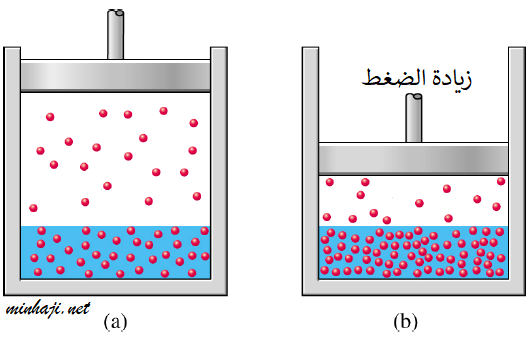
3- الضغط
بزيادة الضغط الخارجي فوق المحلول تزداد ذائبية الغاز في المذيب.
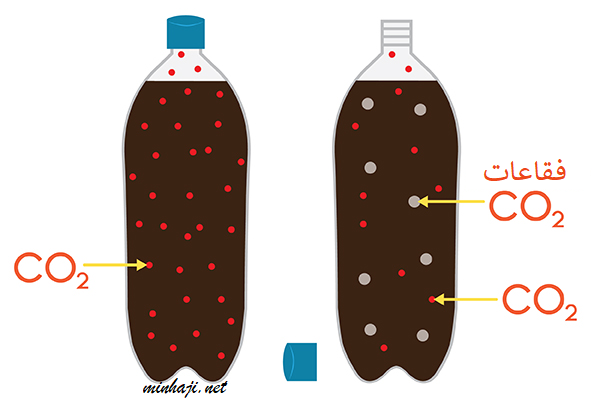
فمثلاً عند فتح علبة المشروب الغاز يقل الضغط المسلط على المحلول فتقل ذائبية غاز CO2 المذاب في السائل فتقل الذائبية فيتصاعد الغاز.
قانون هنري
تمكن العالم هنري من إيجاد علاقة بين ذائبية الغاز والضغط المسلط على سطح السائل.
نص قانون هنري:
"ذائبية الغاز في سائل ما تتناسب طردياً مع الضغط المؤثر في سطح السائل عند ثبات درجة الحرارة".
ويعبر عن قانون هنري رياضياً بالعلاقة:

مثال:
إذا كانت ذائبية غاز ما في الماء عند درجة حرارة 250C وضغط 1.5 atm هي 0.65 g/L ، فما ذائبيته عند ضغط 0.5 atm ؟
تحليل السؤال (المعطيات)
ذائبية الغاز 0.65 g/L = S1
ضغط الغاز 1.5 atm = P1
ضغط الغاز 0.5 atm = P2
المطلوب: حساب ذائبية الغاز S2
الحل:
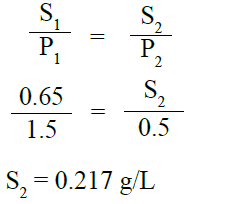
إعداد : أ. أحمد الحسين
02 / 12 / 2021
النقاشات