موازنة المعادلات في وسط قاعدي
خطوات موازنة تفاعلات التأكسد والاختزال بطريقة نصف التفاعل والتي تتم في الوسط القاعدي:
- وازن المعادلة كما لو كانت في وسط حمضي.
- أضف أيونات OH- إلى طرفي المعادلة بعدد أيونات H+.
- اجمع أيوني OH- و H+ على شكل جزيئات ماء.
- احذف جزيئات الماء الزائدة من طرفي المعادلة، وتجمع إذا كانت في الجهة نفسها.
- تحقق من صحة الموازنة بموازنة الذرات والشحنات الكهربائية.
مثال:
وازن المعادلة التالية بطريقة نصف التفاعل علماً بأن التفاعل يتم في وسط قاعدي:
MnO4- + Fe2+ → MnO2 + Fe3+
الحل:
نوازن المعادلة كما لو كانت في وسط حمضي:
MnO4- + 3Fe2+ + 4H+ → MnO2 + 3Fe3+ + 2H2O
إضافة 4OH- إلى طرفي المعادلة:
MnO4-+3Fe2+ + 4H+ +4OH- → MnO2 + 3Fe3+ + 2H2O + 4OH-
جمع أيوني H+ , OH- لتكوين الماء:
MnO4- +3Fe2+ + 4H2O → MnO2 + 3Fe3+ + 2H2O + 4OH-
حذف الماء الزائد من طرفي المعادلة:
MnO4- +3Fe2+ + 2H2O → MnO2 + 3Fe3+ + 4OH-
تأكد بنفسك أن مجموع الشحنات على طرفي المعادلة = +5
سؤال 1 :
وازن المعادلة الآتية بطريقة نصف التفاعل في وسط قاعدي:
Cr2O3 + NO3- → CrO42- + NO2-
سؤال 2 :
وازن المعادلة الآتية في وسط قاعدي، ثم حدد العامل المؤكسد والعامل المختزل فيها:
S2- + I2 → SO42- + I-
سؤال 3 :
وازن المعادلة الآتية في وسط قاعدي:
MnO4- + CH2=CH2 → MnO2 + CH2OHCH2OH
سؤال 4 :
وازن بخطوات المعادلة الكيميائية الآتية بطريقة نصف التفاعل في وسط قاعدي:
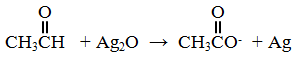
سؤال 5 :
وازن معادلات التأكسد والاختزال التالية بطريقة نصف التفاعل (وسط حمضي):
a) Cu + Cl- + As4O6 → CuCl + As
b) H3AsO4 + Zn → AsH3 + Zn2+
c) S2O82- + I- → IO3- + SO42-
d) CN- + IO3- → CNO- + I-
e) Mn2+ + HBiO3 → Bi3+ + MnO4-
f) Pt + NO3- + Cl- → PtCl62- + NO2
سؤال 6 :
وازن معادلات التأكسد والاختزال التالية بطريقة نصف التفاعل (وسط قاعدي):
a) Cu(NH3)42+ + S2O42- → SO32- + Cu + NH3
b) Cr + CrO42- → Cr(OH)3
c) Ag + CN- + O2 → Ag(CN)2- + H2O
d) CrI3 + Cl2 → CrO42- + IO4- + Cl-
e) PH3 + CrO42- → Cr(OH)4- + P4
سؤال 7 :
وازن معادلات التأكسد والاختزال الذاتي التالية والتي تتم في وسط قاعدي بطريقة نصف التفاعل:
a) P4 → PH3 + H2PO2-
b) Se → Se2- + SeO32-
c) Br2 → Br- + BrO3-
إعداد : أ. أحمد الحسين
08 / 08 / 2020
النقاشات