تعريفات التأكسد والاختزال
مفهوم تفاعل التأكسد والاختزال
تفاعل التأكسد والاختزال: تفاعل كيميائي تحدث فيه عمليتا التأكسد والاختزال معاً.
فالتأكسد والاختزال عمليتان متلازمتان، فلا يحدث أحدهما بمعزل عن الآخر.
الكيمياء الكهربائية: أحد فروع الكيمياء، الذي يهتم بدراسة التحولات بين الطاقة الكيميائية والكهربائية الناتجة من تفاعلات التأكسد والاختزال والتطبيقات العملية المرتبطة بها.
أمثلة على تفاعلات التأكسد والاختزال
1- البناء الضوئي.
2- التنفس.
3- حرق الوقود في وسائل النقل.
4- صدأ الحديد.
أنصاف تفاعل التأكسد والاختزال
يتضمن تفاعل التأكسد والاختزال نصفين، يُسمى الأول نصف تفاعل التأكسد وتوضع فيه الإلكترونات مع النواتج، والثاني نصف تفاعل الاختزال وتوضع فيه الإلكترونات مع المتفاعلات، ويكون عدد الإلكترونات المفقودة يساوي عدد الإلكترونات المكتسبة.
تعريفات التأكسد والاختزال
التعريف الأول:
وهو التعريف الذي استخدمه الكيميائيون القدامى للتأكسد والاختزال.
التأكسد: تفاعل المادة مع الأكسجين.
الاختزال: نزع الأكسجين من المادة.
مثال (1):
يُستخلص الحديد من أكسيد الحديد بوساطة عنصر الكربون وفق المعادلة:
2Fe2O3 (s) + 3C (s) → 3CO2 (g) + 4Fe (s)
وفي هذا التفاعل:
تأكسد الكربون (C)؛ لأنه اتحد مع الأكسجين.
اختزل أيون الحديد (Fe)؛ لأن الأكسجين نُزع من أكسيده.
ويسمى هذا التفاعل (تفاعل تأكسد واختزال).
قصور التعريف الأول
الكثير من التفاعلات لا تتضمن التفاعل مع الأكسجين، وتعتبر تفاعلات تأكسد واختزال.
التعريف الثاني:
وهذا التعريف يتعلق بفقد وكسب الإلكترونات.
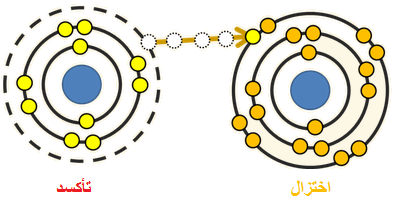
التأكسد: فقد المادة للإلكترونات خلال التفاعل الكيميائي.
الاختزال: كسب المادة للإلكترونات خلال التفاعل الكيميائي.
مثال (2):
أحدد ذرة العنصر التي تأكسدت، وتلك التي اختزلت في التفاعل الآتي، وأكتب أنصاف تفاعلات التأكسد والاختزال.
Ca(s) + Cl2(g) → CaCl2(s)
الحل:
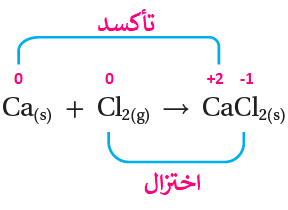
ذرة الكالسيوم تأكسدت بفقد (2e-).
جزيء الكلور اختزل بكسب (2e-).
نصف تفاعل التأكسد: Ca → Ca2+ + 2e-
نصف تفاعل الاختزال: Cl2 + 2e- → 2Cl-
مثال (3):
يتفاعل الحديد مع محلول كبريتات النحاس حسب المعادلة:
Fe (s) + CuSO4 (aq) → Cu (s) + FeSO4 (aq)
أحدد ذرة العنصر التي تأكسدت والأيون الذي اختزل في التفاعل، وأكتب أنصاف تفاعلات التأكسد والاختزال.
الحل:
أكتب معادلة أيونية للتفاعل:
Fe (s) + Cu2+ (aq) + SO42- (aq) → Cu (s) + Fe2+ (aq) + SO42- (aq)
وبحذف أيون (SO42-) المتفرج، تصبح المعادلة الأيونية الصافية:
Fe (s) + Cu2+ (aq) → Cu (s) + Fe2+ (aq)
ذرة الحديد تأكسدت بفقد (2e-).
أيون النحاس اختزل بكسب (2e-).
نصف تفاعل التأكسد: Fe → Fe2+ + 2e-
نصف تفاعل الاختزال: Cu2+ + 2e- → Cu
سؤال (1):
حدد الذرة التي تأكسدت، وتلك التي اختزلت في التفاعلين الآتيين باستخدام مفهوم كسب وفقد الإلكترونات:
2Fe2O3 + 3CO → 2Fe + 3CO2
2Al + 6HCl → 2AlCl3 + 3H2
سؤال (2):
يتفاعل الرصاص مع محلول نترات الفضة وفق المعادلة الآتية:
Pb (s) + 2AgNO3 (aq) → 2Ag (s) + Pb(NO3)2 (aq)
أحدد ذرة العنصر التي تأكسدت والأيون الذي اختزل في التفاعل، وأكتب أنصاف تفاعلات التأكسد والاختزال.
قصور التعريف الثاني
في المركبات الجزيئية التي تترابط ذراتها بروابط تساهمية لا تحدث فيها عملية فقد وكسب إلكترونات.
مثال:
H2 + Cl2 → 2HCl
الرابطة بين ذرتي الكلور والهيدروجين في الجزيء HCl رابطة قطبية، تنزاح الإلكترونات ناحية ذرة الكلور الأعلى سالبية كهربائية، فتكتسب شحنة جزئية سالبة، وتكتسب ذرة الهيدروجين شحنة جزئية موجبة، والتعريف الثاني لم يشمل التفاعلات التي لا يحدث فيها انتقال كلي للإلكترونات بين الذرات، بالرغم من كونها تصنف ضمن تفاعلات التأكسد والاختزال.
التعريف الثالث:
وهذا التعريف يتعلق بالتغير في عدد تأكسد الذرات أو الأيونات.
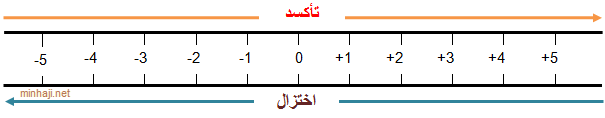
التأكسد: الزيادة في عدد التأكسد.
الاختزال: النقصان في عدد التأكسد.
مثال (4):
يتفاعل النحاس مع محلول نترات الفضة وفق المعادلة:
Cu (s) + 2AgNO3 (aq) → 2Ag (s) + Cu(NO3)2 (aq)
أحدد ذرة العنصر التي تأكسدت والأيون الذي اختزل في التفاعل.
الحل:
أكتب معادلة أيونية للتفاعل:
Cu (s) + 2Ag+ (aq) + 2NO3- (aq) → 2Ag (s) + Cu2+ (aq) + 2NO3- (aq)
أحذف أيون (NO3-) المتفرج:
Cu (s) + 2Ag+ (aq) → 2Ag (s) + Cu2+ (aq)
ذرات النحاس تأكسدت؛ لأن عدد تأكسدها زاد (+2 ← 0 )،
أيونات الفضة اختزلت؛ لأن عدد تأكسدها قل ( 0 ← +1 ).
مثال (5):
أحدد الذرات التي تأكسدت والذرات التي اختزلت في التفاعل الآتي:
SO2 (g) + Br2 (aq) + 2H2O (l) → 2HBr (aq) + H2SO4 (aq)
الحل:
أحدد أعداد التأكسد لجميع الذرات:
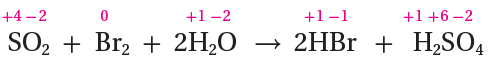
أحدد التغير في أعداد التأكسد:
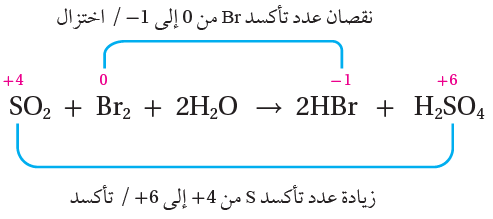
ذرة الكبريت تأكسدت؛ إذ زاد عدد تأكسدها من (+4) إلى (+6)، وزاد بمقدار 2
ذرة البروم اختزلت؛ إذ قل عدد تأكسدها من (0) إلى (-1)، وقل بمقدار 1
مثال (6):
أحدد الذرة التي تأكسدت، وتلك التي اختزلت في التفاعل الآتي باستخدام التغير في عدد التأكسد:
CuO + H2 → Cu + H2O
الحل:
تأكسد الهيدروجين؛ إذ زاد عدد تأكسده من (0) إلى (+1).
اختزل النحاس؛ إذ قل عدد تأكسده من (+2) إلى (0).
سؤال (3):
أحدد الذرة التي تأكسدت، وتلك التي اختزلت في التفاعل التالي باستخدام التغير في عدد التأكسد:
2NO + O2 → 2NO2
سؤال (4):
أحدد الذرات التي تأكسدت والتي اختزلت في كلّ من المعادلات الآتية:
a) Cl2 + 2Br- → 2Cl- + Br2
b) SnO2 + 2C → Sn + 2CO
c) Fe2O3 + 3CO → 2Fe + 3CO2
d) Br- + HSO4- → SO2 + Br2
e) CrO2- + ClO- → CrO42- + Cl-1
إعداد : شبكة منهاجي التعليمية
09 / 11 / 2022
النقاشات