حسابات الحموض الضعيفة
في الحموض الضعيفة يكون تأين الحمض جزئياً، وعليه يمكن حساب [H3O+] عن طريق ثابت الاتزان لتأين الحمض الضعيف في الماء.
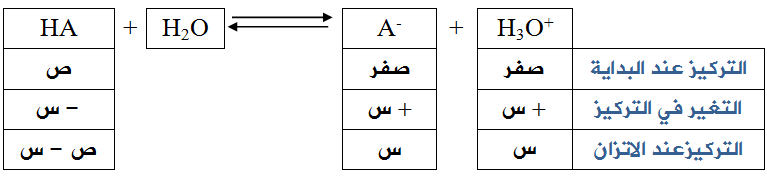
ثابت الاتزان
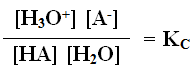
وبما أن [H2O]ثابتاً في المحاليل المائية، لذا يمكن دمجه مع ثابت الاتزان في ثابت جديد هو Ka
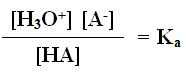
Ka : ثابت تأين الحمض الضعيف، ويتغير من حمض ضعيف لآخر.
وللتسهيل تهمل قيمة (س) المتفككة من الحمض HA ، ويصبح[HA] عند الاتزان = ص
وبما أن [A-] = [H3O+] = س عند الاتزان فإن العلاقة السابقة تصبح:
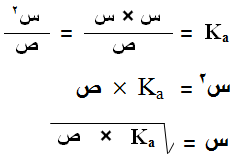
حيث:
س : تركيز أيون الهيدرونيوم أو تركيز الأيون السالب الناتج من تفكك الحمض.
ص : تركيز الحمض الأصلي (تركيزه لا يتغير بعد التفكك).
Ka : ثابت تأين الحمض.
وعليه يمكن إطلاق التعميم التالي:
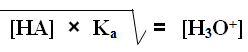
وتستخدم العلاقة السابقة لحساب [H3O+] في محاليل الحموض الضعيفة.
تعد قيمة Ka مقياساً لقدرة الحمض على تكوين أيونات [H3O+] ، فكلما زادت قيمة Ka زاد [H3O+] وزادت قوة الحمض مع ملاحظة أن الحموض القوية ليس لها قيم ثوابت تأين.
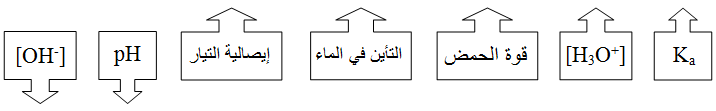
ومن الضروري حفظ العلاقات التالية:
سؤال 1 :
احسب [H3O+] في محلول حمض الميثانويك HCOOH بتركيز 0,1 مول/لتر (Ka = 1,6 × 10-4).
الحل:
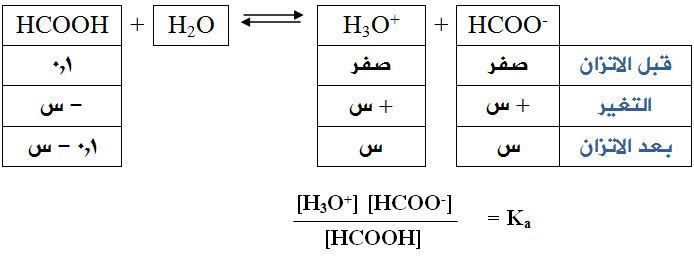
وبما أن [HCOO-] = [H3O+] = س عند الاتزان فإن العلاقة السابقة تصبح :
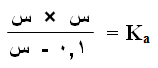
وبإهمال (س) المتفككة من الحمض تصبح العلاقة السابقة على النحو التالي:
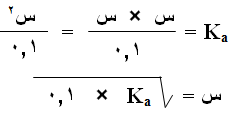
وبالتعويض في ثابت التأين:
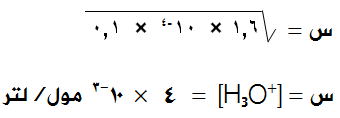
سؤال 2 :
يبين الجدول التالي قيم ثوابت التأين (Ka) لبعض الحموض الضعيفة عند درجة 25هس، ادرس الجدول ثم أجب عن الأسئلة التي تليه:
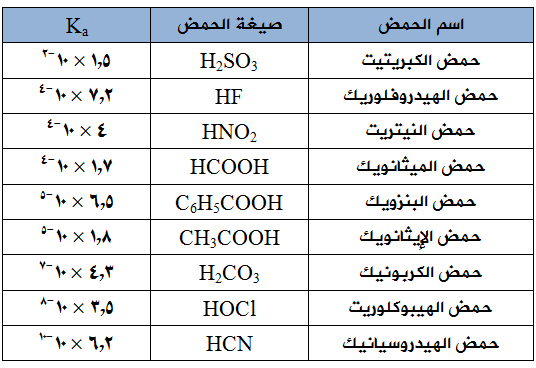
- اكتب صيغة الحمض الأقوى والحمض الأضعف في الجدول، ثم اكتب صيغة القاعدة المرافقة لكل منهما.
- أي الحمضين: H2CO3 أم HNO2المتساويين في التركيز يكون تركيز H3O+ أعلى؟
- أيهما له أعلى رقم هيدروجيني: HF أم HOCl (لهما التركيز نفسه)؟
- أيّ الحمضين: HCOOH أم C6H5COOH أكثر تأيناً في الماء؟
- هل تتوقع أن تكون قيمة pH لمحلول حمض الإيثانويك الذي تركيزه 0,01 مول/لتر أكبر أم أقل من 2 ؟ ولماذا؟
سؤال 3 :
يبين الجدول التالي قيم ثوابت التأين (Ka) لحمضين، أجب عن الأسئلة الآتية:
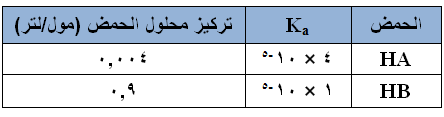
- أي الحمضين أقوى؟
- أي الحمضين أقل تأيناً في الماء؟
- في أي محلولي الحمضين يكون تركيز أيون الهيدرونيوم أعلى؟
- أي محلولي الحمضين أعلى pH ؟
سؤال 4 :
يبين الجدول المجاور تركيز أيون الهيدروكسيد لأربعة حموض ضعيفة متساوية التركيز. ادرس الجدول ثم أجب عن الأسئلة التالية:
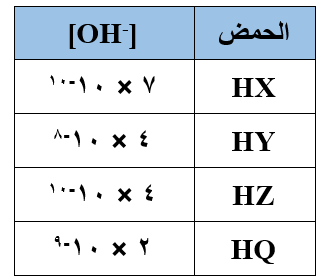 اكتب صيغة الحمض الأقوى.
اكتب صيغة الحمض الأقوى.- اكتب صيغة القاعدة المرافقة في محلول الحمض الأضعف.
- اكتب صيغة القاعدة المرافقة للحمض الذي يمتلك محلوله قيمة pH أعلى.
- ما القاعدة المرافقة لكل من الحموض المذكورة؟
- أي محاليل الحموض المذكوره تمتلك قيمة pH أقل؟
- رتب الحموض الموجودة في الجدول حسب قدرتها على التأين.
- أي محاليل الحموض يوصل التيار الكهربائي بشكل أكبر؟
- أي محلولي الحمضين: ( HX أم HQ ) يمتلك [H3O+] أقل؟
- اكتب صيغ الدقائق الموجودة في محلول HZ عند الاتزان.
سؤال 5 :
احسب قيمة الرقم الهيدروجيني pH لمحلول HF تركيزه 0,05 مول/لتر. (لــو 6 = 0,78)
علماً بأن ثابت تأين الحمض (Ka) يساوي 7,2 × 10-4
سؤال 6 :
احسب تركيز محلول حمض HNO2 الذي رقمه الهيدروجيني pH 2,4
علماً بأن ثابت تأين الحمض (Ka) يساوي 4 × 10-4 . (لــو 4 = 0,6)
سؤال 7 :
احسب قيمة Ka لمحلول الحمض الضعيف HZ الذي تركيزه 0,2 مول/لتر، ورقمه الهيدروجيني يساوي 4
سؤال 8 :
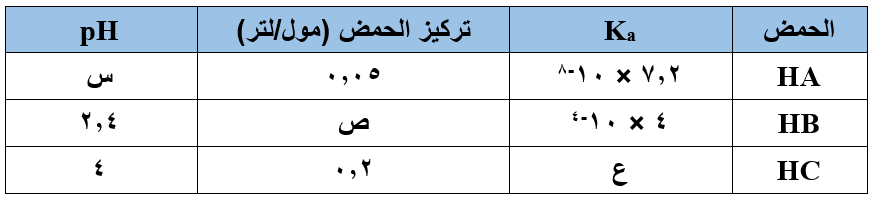
الجدول أدناه يمثل ثلاثة محاليل مائية لثلاثة حموض ضعيفة برموز افتراضية، معتمداً على المعلومات الواردة في الجدول، جد قيم كل من (س)، (ص)، (ع). (لـو 6 = 0,78، لـو 4 = 0,6)
سؤال 9 :
محلول الحمض الضعيف HY تركيزه (1) مول/لتر، وتركيز أيون H3O+ فيه 2 × 10-2 مول/لتر، احسب قيمة pH لمحلول تركيزه (0,01) مول/لتر من الحمض. (لو 2 = 0,3)
سؤال 10 :
أذيب (1,22) غ من حمض البنزويك (C6H5COOH) في لتر من الماء فتبين أن [H3O+] يساوي 8 ×10-4 مول/لتر. احسب قيمة Ka (الكتلة المولية للحمض = 122 غ/مول).
سؤال 11 :
يبين الجدول المجاور بعض محاليل الحموض الضعيفة بتركيز 0,01 مول/لتر لكل منها، ومعلومات عن كل محلول. أجب عن الأسئلة التالية:
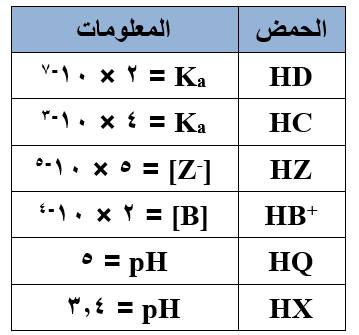 أي الحمضين: HD أم HC هو الأقوى؟
أي الحمضين: HD أم HC هو الأقوى؟- أي محلولي الحمضين: HZ أم HB+ يمتلك [OH-] أعلى؟
- أي الحمضين: HQ أم HX يمتلك قيمة Ka أعلى؟
- أي محلولي الحمضين: HQ أم HZ يمتلك قيمة pH أقل؟
- أي الحمضين: HX أم HZ أكثر تأيناً في الماء؟
- كم تبلغ قيمة pH لمحلول الحمض HB+ ؟ (لـو 2 = 0,3)
- كم تبلغ قيمة pH لمحلول الحمض HB+ تركيزه (1 مول/لتر)؟
(لـو 2 = 0,3)
سؤال 12 :
يبيّن الجدول الآتي عدداً من محاليل الحموض الافتراضية الضعيفة متساوية التركيز (0,1) مول/لتر وقيم pH لها، ادرسه ثمّ أجب عن الأسئلة التي تليه:
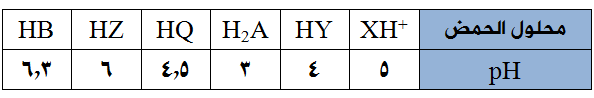
- أي الحمضين أقوى: HY أم HQ ؟
- اكتب معادلة تفاعل B- مع H2A .
- أي حموض الجدول يمتلك قيمة Ka أعلى؟
- كم تبلغ قيمة Ka للحمض HZ ؟
- ما صيغة القاعدة المرافقة لكل من الحمضين H2A و XH+ ؟
سؤال 13 :
رتب محاليل الحموض التالية تصاعدياً وفق زيادة قيمة pH إذا كانت تراكيزها متساوية:
CH3COOH (Ka = 1,8 × 5-10) ، HCl ، HCOOH (Ka = 1,7× 4-10)
سؤال 14 : سؤال موضوعي وزاري
إذا كانت قيمة pH تساوي (3) لمحلول من الحمض الضعيف HA تركيزه (0,1) مول/لتر . فإن قيمة Ka لهذا الحمض تساوي:
أ) 1 × 10-5 ب) 1 × 10-6 ج) 1 × 10-7 د) 1 × 10-8
إجابات أسئلة الدرس في الملفات المرفقة.
إعداد : أ. أحمد الحسين
06 / 05 / 2022
النقاشات