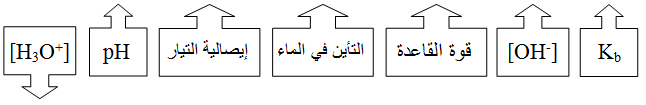
حسابات القواعد الضعيفة
في القواعد الضعيفة يكون تأين القاعدة جزئياً، وعليه يمكن حساب [OH-] عن طريق ثابت الاتزان لتأين القاعدة الضعيفة في الماء.
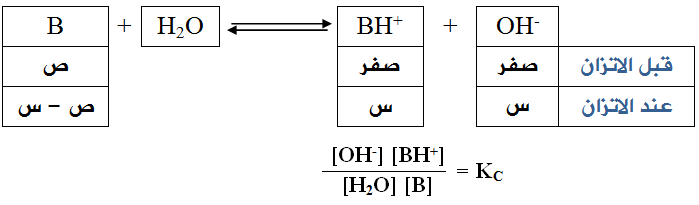
وبما أن [H2O] ثابتاً في المحاليل المائية، لذا يمكن دمجه مع ثابت الاتزان في ثابت اتزان جديد هو Kb
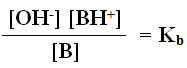
Kb : ثابت تأين القاعدة الضعيفة، ويتغير من قاعدة ضعيفة لأخرى.
وللتسهيل تهمل قيمة (س) المتفككة من القاعدة B ، ويصبح[B] = ص
وبما أن [BH+] = [OH-] = س عند الاتزان فإن العلاقة السابقة تصبح:
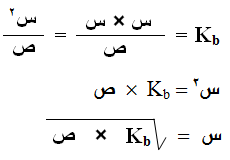
حيث:
س : تركيز أيون الهيدروكسيد أو تركيز الأيون الموجب الناتج من تفكك القاعدة.
ص : تركيز القاعدة الأصلي (تركيزها لا يتغير بعد التفكك).
Kb : ثابت تأين القاعدة.
وعليه يمكن إطلاق التعميم التالي:
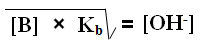
وتستخدم العلاقة السابقة لحساب [OH-] في محاليل القواعد الضعيفة.
تعد قيمة Kb مقياساً لقدرة القاعدة على تكوين أيونات OH- ، فكلما ارتفعت قيمته زاد [OH-] وزادت قوة القاعدة، مع ملاحظة أن القواعد القوية ليس لها قيم ثوابت تأين.
احفظ العلاقات التالية:
سؤال 1 :
احسب الرقم الهيدروجيني لمحلول الأمونيا NH3 تركيزه (0,2) مول/لتر.
( ثابت التأين Kb للأمونيا = 2 × 10-5). (لـو 5 = 0,7).
الحل:
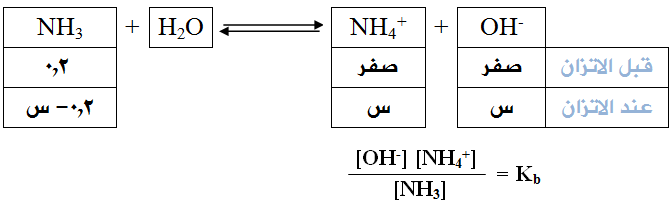
وبما أن [NH4+] = [OH-] = س عند الاتزان فإن العلاقة السابقة تصبح:
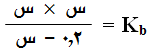
وبإهمال (س) المتفككة من القاعدة لتصبح العلاقة السابقة على النحو التالي:
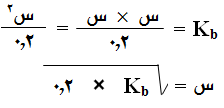
وبالتعويض في ثابت التأين:
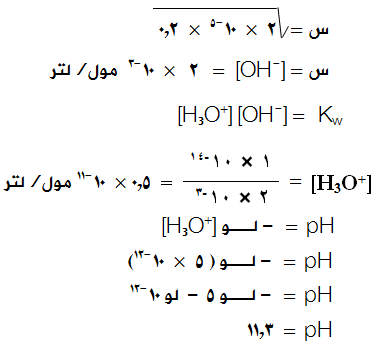
سؤال 2 :
يبين الجدول التالي قيم ثوابت التأين (Kb) لبعض القواعد الضعيفة عند درجة 525س، ادرس الجدول ثم أجب عن الأسئلة التي تليه:
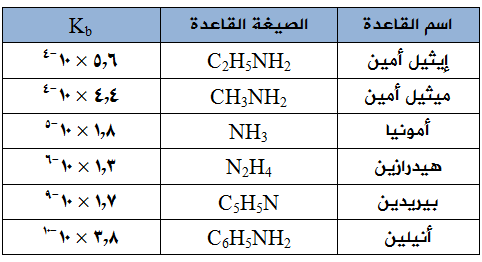
- اكتب صيغة القاعدة الأقوى في الجدول، وصيغة حمضها المرافق.
- اكتب صيغة الحمض المرافق للقاعدة الأضعف.
- أيهما يكون تركيز أيون OH- فيه أعلى: محلول الأمونيا أم محلول البيريدين (لهما التركيز نفسه)؟
- أيهما أعلى قيمة pH محلول ميثيل أمين، أم محلول الهيدرازين (إذا كانا بالتركيز نفسه)؟
- هل تتوقع أن تكون قيمة pH لمحلول الأمونيا الذي تركيزه 0,001 مول/لتر أكبر أم أقل من 11؟ فسر إجابتك؟
سؤال 3 :
يبين الجدول المجاور [OH-] لبعض القواعد الضعيفة، فإذا كان لديك محاليل متساوية التركيز من تلك القواعد فأجب عن الأسئلة التالية:
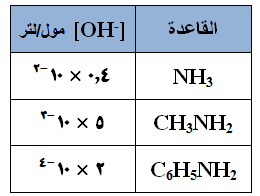 ما الحمض المرافق لكل من القواعد المذكورة؟
ما الحمض المرافق لكل من القواعد المذكورة؟- اكتب صيغة القاعدة الأضعف؟
- رتب محاليل القواعد الموجودة في الجدول حسب قيمة pH .
- رتب محاليل القواعد الموجودة في الجدول حسب [H3O+].
- أي محاليل القواعد يمتلك أقل ثابت تأين Kb ؟
- أي القواعد المذكورة في الجدول أكثر تأيناً في الماء؟
- أي محاليل تلك القواعد أقل إيصالاً للتيار الكهربائي؟
سؤال 4 :
البيريدين قاعدة ضعيفة، فإذا علمت أن Kb = 1,6× 10-9، فاحسب (pH) لمحلول (0,01) مول/لتر منه. (لـو 0,25 = -0,6، Kw = 1 × 10-14)

سؤال 5 :
احسب كتلة الأمونيا NH3 اللازم إذابتها في الماء لتحضير محلول حجمه 400 مل ورقمه الهيدروجيني 12 علماً بأن قيمة Kb للأمونيا = 2 × 10-5. (الكتلة المولية للأمونيا = 17 غ/مول، Kw = 1 × 10-14)
سؤال 6 :
كم مولاً من الهيدرازين N2H4 يلزم لتحضير محلول حجمه 0,2 لتراً، ورقمه الهيدروجيني 10,9، علماً بأن Kb للهيدرازين = 1 × 10-6، و (لــو 1,25 = 0,1، Kw = 1 × 10-14)
سؤال 7 :
محلول القاعدة الضعيفة B تركيزها (1) مول/لتر، وتركيز أيون OH- في محلولها 4 × 10-3 مول/لتر، احسب قيمة pH لمحلول تركيزه (0,01) مول/لتر من القاعدة. (لو 0,25 = -0,6، Kw = 1 × 10-14)
سؤال 8 :
يبيّن الجدول الآتي عدداً من محاليل القواعد الافتراضية الضعيفة متساوية التركيز (0,1) مول/لتر وقيم pH لها، ادرسه ثمّ أجب عن الأسئلة التي تليه:
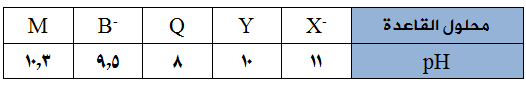
- أي القاعدتين أقوى: Y أم Q ؟
- اكتب معادلة تفاعل B- مع الماء.
- أي قواعد الجدول يمتلك قيمة Kb أقل؟
- كم تبلغ قيمة Kb للقاعدة M ؟ (لـو 5 = 0,7)
- أي قواعد الجدول يتفاعل بدرجة أكبر مع الماء؟
سؤال 9 :
يبين الجدول أدناه الرقم الهيدروجيني pH لعدد من المحاليل والتي مثلت بالرموز F-A :
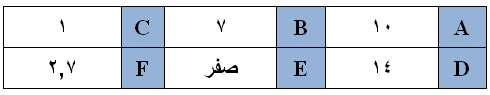
أي المحاليل في الجدول أعلاه يمكن أن يكون محلولاً لـ :
- حمض النتريك HNO3 بتركيز 1 مول/لتر.
- حمض CH3COOH بتركيز 0,2 مول/لتر (Ka = 2 × 10-5)، (لـو 2 = 0,3)
- هيدروكسيد البوتاسيوم KOH بتركيز 1 مول/لتر.
- محلول N2H4 تركيزه (0,01 مول/لتر). (Kb = 1 × 10-6)
سؤال 10 :
يبين الجدول المجاور بعض القواعد الضعيفة بتركيز 0,2 مول/لتر لكل منها. أجب عن الأسئلة التالية:
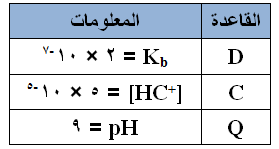 احسب قيمة pH لمحلول القاعدة D .
احسب قيمة pH لمحلول القاعدة D . - اكتب صيغة الحمض المرافق للقاعدة الأضعف.
- أي محاليل القواعد تمتلك أعلى قيمة للرقم الهيدروجيني pH ؟
- أي قواعد الجدول يتأين بشكل أقل في الماء؟
- حدد صيغ الدقائق الموجودة في محلول Q عند الاتزان.
سؤال 11 :
رتب محاليل المواد التالية تصاعدياً حسب زيادة قيمة pH إذا كانت تراكيزها متساوية:
HNO3 ، HF (Ka = 7,2 × 4-10) ، KOH ، N2H4 (Kb = 1,3 × 6-10) ، NH2OH (Kb = 1,1 × 8-10) ، H2CO3 (Ka = 4,3 × 7-10).
سؤال 12 : أسئلة موضوعية وزارية
1- في محلول مائي لـ N2H4 تركيزه (0,01) مول/لتر، Kb لـ N2H4 = 1 × 10-6، فإن قيمة pH للمحلول تساوي:
أ) 4 ب) 8 ج) 10 د) 12
2- محلول مائي لقاعدة ضعيفة B تركيزه (0,01) مول/لتر ، وكان Kb لها = 1,6 × 10-9 ، (Kw = 1 × 10-14)؛ فإن [H3O+] في المحلول (بالمول/لتر) يساوي:
أ) 4 × 10-5 ب) 4 × 10-6 ج) 2,5 × 10-9 د) 12,5 × 10-10
إجابات أسئلة الدرس في الملفات المرفقة.
إعداد : أ. أحمد الحسين
06 / 05 / 2022
النقاشات