نظرية التصادم وسرعة التفاعلات

وضعت نظرية التصادم لتفسير كيفية حدوث التفاعل الكيميائي، وفهم أثر العوامل المختلفة المؤثرة في سرعة حدوثه.
افتراضات نظرية التصادم:
الافتراض الأول:
التصادم بين دقائق المواد المتفاعلة شرط أساسي لحدوث التفاعل الكيميائي.
الافتراض الثاني:
سرعة التفاعل الكيميائي تتناسب طردياً مع عدد التصادمات الحاصلة بين دقائق المواد المتفاعلة في وحدة الزمن.
الافتراض الثالث:
يجب أن يكون التصادم بين المتفاعلات فعالاً كي يحدث التفاعل.
التصادم الفعال: التصادم الذي يؤدي إلى تكوين نواتج.
وحتى يكون التصادم فعالاً لا بد من شرطين، هما:
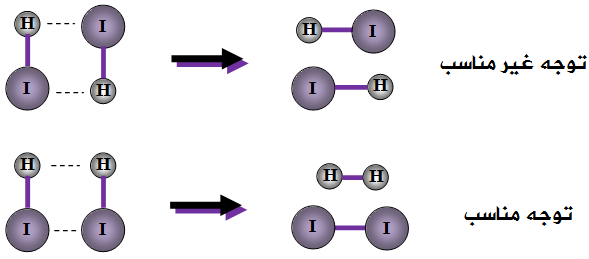
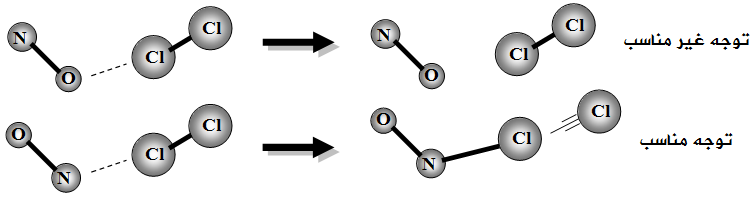
- أن يكون اتجاه التصادم مناسباً.
- توفر طاقة التنشيط (Ea).
توضيح اتجاه التصادم بأمثلة:
مثال (1):
انظر إلى التفاعل التالي:
2HI → H2 + I2
مثال (2):
انظر إلى التفاعل التالي:
NO + Cl2 → NOCl + Cl
توضيح مفهوم طاقة التنشيط
طاقة التنشيط: الحد الأدنى من الطاقة اللازمة لكسر الروابط بين ذرات المواد المتفاعلة، وتكوين روابط جديدة.
وكلما زادت طاقة التنشيط قلت سرعة التفاعل.
وعندما تكتسب المتفاعلات طاقة تنشيط يتكون بناء غير مستقر يسمى المعقد المنشط.
المعقد المنشط: بناء غير مستقر بين المواد المتفاعلة والمواد الناتجة له طاقة وضع عالية.
سؤال 1:
ارسم بناء المعقدين المنشطين في التفاعليين التاليين:
A) H2 + I2 → 2HI
B) NO + Cl2 → NOCl + Cl
سؤال 2:
في التفاعل التالي: CO + H2O → CO2 + H2 حدث تصادم بين CO و H2O وكان التوجه مناسباً، ولكن لم يحدث تفاعل، فكيف تفسر ذلك؟
سؤال 3:
ارسم التوجه المناسب للتفاعلين التاليين:
A) CO + H2O → CO2 + H2
B) NO + CO2 → NO2 + CO
سؤال 4:
إذا كان لديك التفاعل العام التالي:
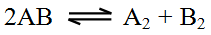
- ارسم التوجه المناسب لتفاعل تفكك AB .
- ارسم التوجه المناسب لتفاعل تكوّن AB .
إعداد : أ. أحمد الحسين
23 / 04 / 2018
النقاشات