العوامل المؤثرة في سرعة التفاعل
تتأثر سرعة التفاعل بعوامل متعددة أهمها:
- تراكيز المواد المتفاعلة.
- طبيعة المواد المتفاعلة.
- مساحة سطح المواد المتفاعلة في الحالة الصلبة.
- درجة الحرارة.
- وجود العوامل المساعدة.
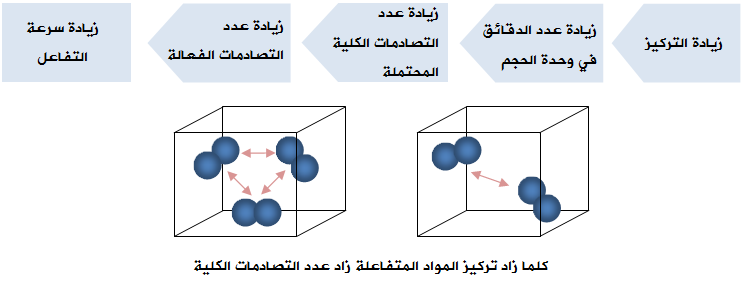
أولاً: تركيز المواد المتفاعلة
زيادة تركيز أحد المواد المتفاعلة يؤدي إلى زيادة سرعة التفاعل، ويمكن تفسير أثر التركيز على سرعة التفاعل اعتماداً على نظرية التصادم على النحو التالي:
فعند زيادة تراكيز المواد المتفاعلة يزداد عدد الدقائق في وحدة الحجم، ويزداد معها عدد التصادمات الكلية المحتملة بين دقائقها، وبالتالي يزداد عدد التصادمات الفعالة، فتزداد سرعة التفاعل.
مثال:
يتفاعل المغنيسيوم مع حمض الهيدروكلوريك HCl وفق التفاعل:
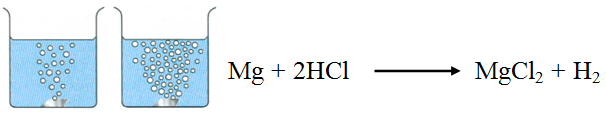
تزداد سرعة تصاعد غاز الهيدروجين الناتج من تفاعل المغنيسيوم مع حمض الهيدروكلوريك بزيادة تركيز الحمض.
فسّر ذلك بالاعتماد على نظرية التصادم.
التفسير:
زيادة تركيز HCl يزيد من عدد أيونات H+ و Cl- الموجودة في وحدة الحجم، فيزداد عدد التصادمات الكلية المحتملة بينها وبين دقائق المغنيسيوم، فيزداد عدد التصادمات الكلية المحتملة، وزيادة عدد التصادمات الفعالة، فتزداد سرعة التفاعل.
ثانياً: طبيعة المواد المتفاعلة
- الفلزات النشطة تتفاعل أسرع من الفلزات الأقل نشاطاً.
مثال:
تفاعل الصوديوم مع الماء أسرع من تفاعل المغنيسيوم؛ لأن الصوديوم أكثر نشاطاً من المغنيسوم، فالصوديوم يحتوي على إلكترون واحد في مداره الأخير مما يسهل فقده.
- تتفاعل محاليل المواد أسرع من تفاعل مساحيقها.
مثال:
يتفاعل يوديد البوتاسيوم KI مع نترات الفضة AgNO3 وفق المعادلة التالية:
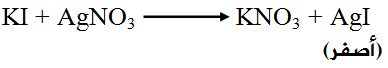
سرعة ظهور اللون الأصفر عند مزج محلولي نترات الفضة ويوديد البوتاسيوم أسرع من سرعة ظهور اللون الأصفر عند مزج مسحوقهما؛ لأن الأيونات في حالة المسحوق تكون مقيدة، وفي حالة المحلول تكون حرة الحركة، وهذا بدوره يزيد من عدد التصادمات الكلية المحتملة بين الأيونات، فيزداد عدد التصادمات الفعالة، وتزداد سرعة التفاعل.
ثالثاً: مساحة سطح المواد المتفاعلة في الحالة الصلبة
تؤدي زيادة مساحة سطح المواد المتفاعلة إلى زيادة سرعة التفاعل، وتفسر حسب نظرية التصادم على النحو التالي: فعند زيادة مساحة سطح المواد المتفاعلة يزداد عدد التصادمات الكلية المحتملة ويزداد عدد التصادمات الفعالة فتزداد سرعة التفاعل .
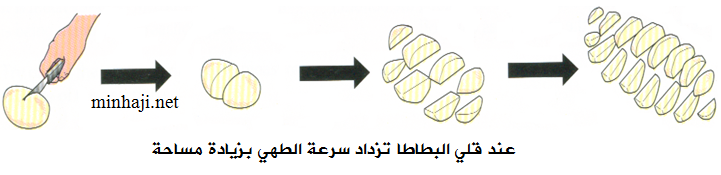
أمثلة:
- تتفاعل قطع صغيرة من الطباشير مع محلول الخل أسرع من تفاعل القطع الكبيرة.
- تصدأ برادة حديد كتلتها (10 غ) بسرعة أكبر من سلك من الحديد كتلته (10 غ) إذا تعرضا للظروف الجوية نفسها.
- تحترق نشارة الخشب بسرعة أكبر من احتراق قطع الخشب.
رابعاً: درجة الحرارة
إن رفع درجة الحرارة يؤدي إلى زيادة سرعة التفاعل.
أمثلة:
- ينضج الطعام أسرع عندما نزيد درجة الحرارة.
- نضع الأطعمة في الثلاجة لتقليل احتمالية حدوث التفاعلات التي تؤدي إلى تحللها وفسادها.
- تحفظ الأدوية في درجات حرارة معينة لمنع تلفها.
- يختفي اللون البنفسجي لبيرمنغنات البوتاسيوم عند تفاعله مع حمض الأوكزاليك أسرع بالتسخين، إذا ما قورن تفاعلهما في درجة حرارة الغرفة.
تفسير أثر درجة الحرارة على سرعة التفاعل حسب نظرية التصادم:
لتفسير أثر درجة الحرارة على سرعة التفاعل علينا أن ندرس منحنى ماكسويل – بولتزمان.
توزيع ماكسويل - بولتزمان لتفاعل عند درجتين حراريتين مختلفتين:
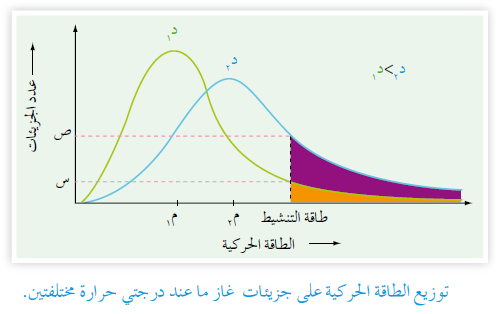
زيادة درجة الحرارة تؤدي إلى زيادة متوسط الطاقة الحركية للجزيئات (م) مع بقاء طاقة التنشيط ثابتة، وهذا يؤدي إلى زيادة عدد الجزيئات التي تمتلك طاقة طاقة التنشيط (س)، وتزداد عدد الجزيئات التي تمتلك طاقة تنشيط أو أكبر منها (المساحة المظللة)، وبالتالي تزداد عدد التصادمات الفعالة، وهذا من شأنه زيادة سرعة التفاعل.

سؤال 1 :
من خلال دراستك لمنحنى ماكسويل - بولتزمان ولنظرية التصادم، ما أثر زيادة درجة الحرارة على كلّ من:
- متوسط (معدل) الطاقة الحركية للجزيئات.
- عدد التصادمات الكلية المحتملة.
- عدد التصادمات الفعالة.
- عدد الجزيئات التي تمتلك طاقة التنشيط.
- عدد الجزيئات التي تمتلك طاقة التنشيط أو أكبر منها.
- سرعة التفاعل.
- طاقة التنشيط.
سؤال 2 :
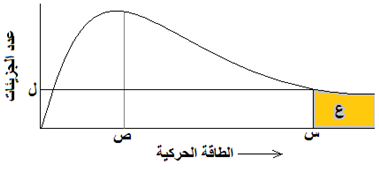 الشكل المجاور يمثل منحنى ماكسويل – بولتزمان لتفاعل ما عند درجة 300 كلفن. ادرس الشكل ثم أجب عن الأسئلة التي تحاذيه:
الشكل المجاور يمثل منحنى ماكسويل – بولتزمان لتفاعل ما عند درجة 300 كلفن. ادرس الشكل ثم أجب عن الأسئلة التي تحاذيه:
- ماذا تمثل الرموز: س ، ص ، ع ، ل؟
- ماذا يحدث لقيمة كلّ من: س ، ص ، ل ، ع إذا أصبحت قيمة درجة الحرارة 400 كلفن؟
سؤال 3 :
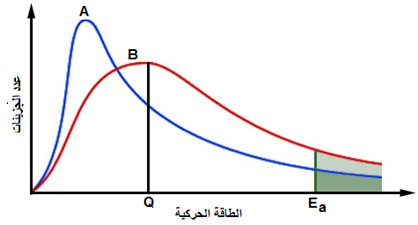 الشكل المجاور يمثل منحنى ماكسويل – بولتزمان لتفاعل ما عند درجتين حراريتين مختلفتين. أجب عن الأسئلة التالية:
الشكل المجاور يمثل منحنى ماكسويل – بولتزمان لتفاعل ما عند درجتين حراريتين مختلفتين. أجب عن الأسئلة التالية:
- ما رمز المنحنى الذي يمثل درجة الحرارة الأعلى؟
- ما الذي يمثله الرمز Q ؟
- ما رمز المنحنى الذي تكون عنده سرعة التفاعل أعلى؟ ما السبب وفق هذا المنحنى؟
سؤال 4 :
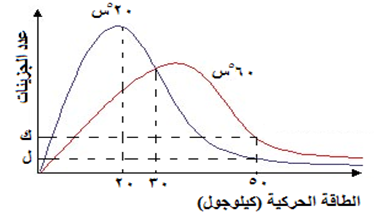 من خلال دراستك للشكل الآتي والذي يمثل منحنى ماكسويل - بولتزمان لتوزيع الطاقة الحركية لتفاعل ما عند درجتي حرارة 20هس ، 60هس، أجب عما يلي:
من خلال دراستك للشكل الآتي والذي يمثل منحنى ماكسويل - بولتزمان لتوزيع الطاقة الحركية لتفاعل ما عند درجتي حرارة 20هس ، 60هس، أجب عما يلي:
- ما مقدار طاقة التنشيط للتفاعل؟
- ماذا يمثل الرمزين (ك) و (ل)؟
- ما دلالة مقدار الطاقة الحركية (20) كيلوجول؟
- هل يمكن لجزيء طاقته الحركية (40) كيلوجول أن يتفاعل؟
إعداد : أ. أحمد الحسين
23 / 04 / 2018
النقاشات