الكواشف
Indicators
تستخدم الكواشف لتحديد نقطة التكافؤ أثناء عملية المعايرة.
الكواشف: حموض عضوية ضعيفة أو قواعد ضعيفة يتغير لونها في الحالة المتأينة عن الحالة غير المتأينة في مدى معين من الرقم الهيدروجيني.
آلية عمل الكواشف
الكواشف حموض أو قواعد ضعيفة يختلف لونها في الحالة المتأينة عنه في الحالة غير المتأينة، تبعاً للوسط الذي توجد فيه، فلو افترضنا أن لدينا كاشفاً حمضياً صيغته (HIn)، فإن قاعدته المرافقة سوف تأخذ الرمز (In-)، ويوصف تأين الكاشف بمعادلة الاتزان التالية:
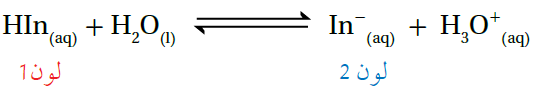
عند إضافة الكاشف HIn إلى محلول حمضي، حيث يكون تركيز H3O+ عالياً، يندفع الاتزان في معادلة الكاشف بالاتجاه العكسي، مما يؤدي إلى زيادة تركيز HIn مقارنة بتركيز In-، وبالتالي يسود في المحلول اللون (1).
أما عند إضافة الكاشف HIn إلى محلول قاعدي يحتوي على أيونات OH- ، فإنها تتفاعل مع جزيئات الحمض HIn، مما يسبب تناقص تركيز الحمض HIn ، وبالتالي زيادة تركيز القاعدة المرافقة In- ، ويسود في المحلول اللون (2).
ويمكن ملاحظة التغير اللوني للكاشف عندما تصل النسبة بين [In-] و [HIn] إلى قيمة معينة خاصة بالكاشف، وتعتمد هذه النسبة على تركيز أيون الهيدرونيوم في المحلول، أي على قيمة pH .
يتم اختيار الكاشف في عملية المعايرة بحيث يكون مدى التغير اللوني للكاشف قريب من نقطة التكافؤ أو التعادل.
مثال:
عند معايرة حمض قوي مثل HCl مع قاعدة قوية مثل NaOH يستخدم الفينولفثالين أو الميثيل الأحمر؛ لأن لونهما في مدى قريب من نقطة التعادل.
الجدول التالي يبين مدى الرقم الهيدروجيني لتغير ألوان بعض الكواشف:
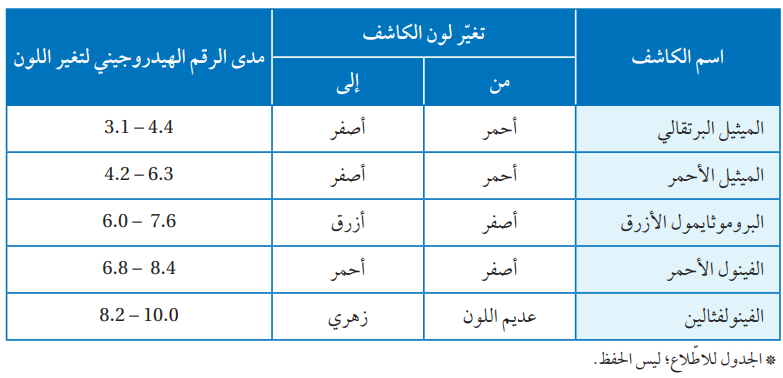
وتعتمد دقة المعايرة على اختيار الكاشف المناسب، فمثلاً عند معايرة حمض HCl مع هيدروكسيد الصوديوم NaOH ، تكون درجة حموضة المحلول الناتج عند نقطة التكافؤ تساوي 7 ، ولهذا نختار أحد الكواشف التي يكون التغير اللوني فيها أقرب ما يكون لهذا الرقم، كما يمكن استخدام ألوان الكواشف لمعرفة إن كان المحلول حمضياً أو قاعدياً.
سؤال (1):
أحدد، باستخدام الجدول، لون الكاشف في كل من المحاليل الآتية:
1- الميثيل الأحمر في محلول قاعدي.
2- البروموثايمول الأزرق في محلول حمضي.
سؤال (2):
يتأين الكاشف الحمضي HIn حسب المعادلة:
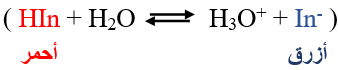
فإذا أضيف محلول NaOH إلى هذا الكاشف، فأجيب عن الأسئلة الآتية:
1- أي اللونين يسود في المحلول؟
2- ماذا يحدث لتركيز HIn ؟ (يزداد، يقل، لا يتغير)
3- ماذا يحدث تركيز In- ؟ (يزداد، يقل، لا يتغير)
4- ما لون الكاشف قبل إضافة حمض أو قاعدة إليه؟
سؤال (3):
كاشف قاعدي (In) لونه برتقالي في الحالة غير المتأينة ولونه بنفسجي في الحالة المتأينة:
1- ما اللون الذي يسود في محلول الكاشف إذا أضيف إليه محلول KOH ؟
2- ما اللون الذي يسود في محلول الكاشف إذا أضيف إليه محلول HNO3 ؟
3- ماذا يحدث تركيز HIn+ عند إضافة HCl لمحلول الكاشف؟ (يزداد، يقل، لا يتغير)
إعداد : شبكة منهاجي التعليمية
21 / 09 / 2024
النقاشات