أسئلة المحتوى وإجاباتها
الرقم الهيدروجيني ومحاليل الحموض والقواعد القوية
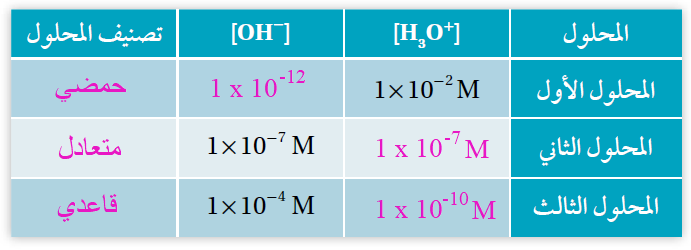
أتحقق صفحة (24):
يبين الجدول الآتي تراكيز H3O+ و OH- لثلاثة محاليل. أكمل الفراغات في الجدول بما يناسبها:
أتحقق صفحة (26):
أحسب تركيز H3O+ وتركيز OH- في محلول حمض النيتريك HNO3 تركيزه 0.04 M
الحل:
معادلة تأين الحمض:
HNO3 + H2O → H3O+ + NO3-
[H3O+] = [HNO3] = 4 x 10-2 M
[H3O+] [OH-] = 1 x 10-14 Kw =
[OH-] = = = 0.25 x 10-12 = 2.5 x 10-13 M
أتحقق صفحة (28):
أحسب تركيز H3O+ وتركيز OH- في المحاليل الآتية:
1- محلول القاعدة هيدروكسيد البوتاسيوم KOH الذي تركيزه 0.5 M
2- محلول جرى تحضيره بإذابة 8 g من بلورات هيدروكسيد الصوديوم NaOH في 200 mL من الماء.
علماً أن = 40 g/mol(NaOH) Mr
الحل:
1- معادلة تأين القاعدة:
KOH K+ + OH-
[OH-] = [KOH] = 0.5 M
[H3O+] [OH-] = 1 x 10-14 Kw =
[H3O+] = = = 0.2 x 10-13 = 2 x 10-14 M
2-
أحسب عدد مولات القاعدة (n) في المحلول:
n = = = 0.2 mol
أحسب تركيز الحمض (M) في المحلول:
M = = = 1 M
معادلة تأين القاعدة:
NaOH Na+ + OH-
[OH-] = [NaOH] = 1 M
[H3O+] [OH-] = 1 x 10-14 Kw =
[H3O+] = = = 1 x 10-14 M
أتحقق صفحة (29):
1- أحدد الرقم الهيدروجيني للمحاليل الآتية:
أ) محلول H3O+ فيه يساوي 10-3 M
ب) محلول تركيز H3O+ فيه يساوي 10-12 M
2- أستنتج أيّ المحلولين السابقين حمضي وأيهما قاعدي.
الحل:
1- المحلول (أ) قيمة الرقم الهيدروجيني يساوي (3)، والمحلول (ب) قيمة الرقم الهيدروجيني يساوي (12).
2- المحلول (أ) حمضي، والمحلول (ب) قاعدي.
أفكر صفحة (30):
أستنتج تركيز المحلول إذا كان رقمه الهيدروجيني يساوي صفراً (pH = 0).
الحل:
[H3O+] = 10-pH = 100 = 1 M
أتحقق صفحة (32):
1- أحسب pH لمحلول حمض الهيدرويوديك HI تركيزه 0.03 M علماً أن log 3 = 0.48 .
2- أحسب [H3O+] لعينة من عصير البندورة رقمها الهيدروجيني يساوي 4.3
علماً log 5 = 0.7 .
3- أحسب pH لمحلول القاعدة هيدروكسيد الليثيوم LiOH تركيزه 0.004 M علماً أن log 2.5 = 0.4 .
الحل:
1- معادلة تأين الحمض:
HI + H2O → H3O+ + I-
[H3O+] = [HI] = 0.03 M = 3 x 10-2 M
pH = - log [H3O+]
pH = - log (3 x 10-2) = 2 – log 3 = 2 - 0.48 = 1.52
2-
[H3O+] = 10-pH = 10-4.3 = 5 x 10-5 M
3- معادلة تأين القاعدة:
LiOH Li+ + OH-
[OH-] = [NaOH] = 4 x 10-3 M
[H3O+] [OH-] = 1 x 10-14 Kw =
[H3O+] = = = 0.25 x 10-11 M = 2.5 x 10-12 M
pH = - log [H3O+]
pH = - log (2.5 x 10-12) = 12 – log 2.5 = 12 - 0.4 = 11.6
أتحقق صفحة (33):
1- أحسب الرقم الهيدروكسيلي pOH لمحلول هيدروكسيد الليثيوم LiOH تركيزه 0.004 M
(علماً log 4 = 0.6).
2- أحسب [OH-] لعبوة مكتوب عليها أن الرقم الهيدروكسيلي pOH يساوي 3.2
(علماً log 6.3 = 0.8).
الحل:
1-
معادلة تأين القاعدة:
LiOH Li+ + OH-
pOH = - log [OH-]
pOH = - log (4 x 10-3) = 3 – log 4 = 3 – 0.6 = 2.4
2-
[OH-] = 10-pOH = 10-3.2 = 6.3 x 10-4
أتحقق صفحة (34):
أحسب كلاً من pH و pOH لكل من المحاليل الآتية:
1- محلول تركيز أيونات H3O+ فيه يساوي 10-5 M
2- محلول تركيز أيونات OH- فيه يساوي 10-4 M
الحل:
1-
pH = - log [H3O+]
pH = - log (1 x 10-5) = 5
pH + pOH = 14
pOH = 14 – 5 = 9
2-
pOH = - log [OH-]
pOH = - log (1 x 10-4) = 4
pH + pOH = 14
pOH = 14 – 4 = 10
أتحقق صفحة (37):
أحسب تركيز محلول القاعدة KOH إذا تعادل 20 mL منه تماماً مع 30 mL من محلول الحمض HBr تركيزه 0.2 M وفق المعادلة الآتية:
HBr (aq) + KOH (aq) → KBr (aq) + H2O (l)
عند نقطة التعادل يكون:
عدد مولات الحمض = عدد مولات القاعدة
n (KOH) = n (HBr)
(M x V) KOH = (M x V) HBr
(M x 0.02) = (0.2 x 0.03)
MKOH = 0.3 M
أتحقق صفحة (38):
أستعين بالجدول (7) في تحديد لون الكاشف في كل من المحاليل الآتية:

1- الميثيل الأحمر في محلول قاعدي. (أصفر)
2- البروموثايمول الأزرق في محلول حمضي. (أزرق)
إعداد : شبكة منهاجي التعليمية
15 / 08 / 2024
النقاشات