نموذج رذرفورد النووي
Rutherford’s Nuclear Model
لم يصمد نموذج ثومسون طويلاً، فقد أثبت العالم إرنست رذرفورد بالتجربة أن الذرة ليست متجانسة كما اقترح ثومسون.
تجربة رذرفورد
سلط رذرفورد جسيمات ألفا (موجبة الشحنة) مصدرها ذرات عناصر مشعة على صفيحة رقيقة من الذهب.
توقع رذرفورد أن تمر جميع دقائق ألفا خلال الصفيحة بالطريقة نفسها؛ لأن الذرة متجانسة وفق تصور ثومسون.
بعد أن أجرى رذرفورد تجربته لاحظ ما يلي:
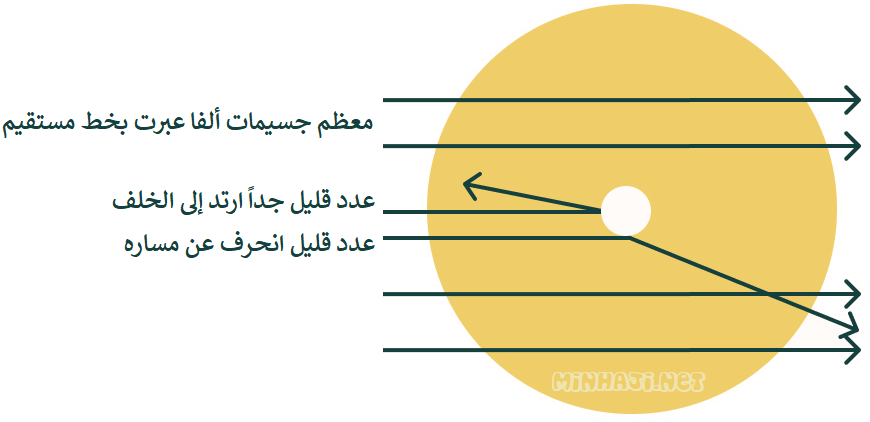
- نفذت معظم دقائق ألفا عبر رقاقة الذهب دون أن تعاني أي انحراف، فاستدل على ذلك بأنها لم تجد أي عائقاً، أي أن معظم حجم الذرة فراغ.
- نسبة ضئيلة من دقائق ألفا ارتدت عن مسارها كلياً؛ دلالة على اصطدامها مباشرة بجسيمات تشغل حيزاً صغيراً بالنسبة لحجم الذرة وشحنتها موجبة، وافترض أنها تشكل نواة الذرة.
- جزء بسيط من دقائق ألفا انحرف عن مساره نظراً لمروره بالقرب من النواة الموجبة، فتنافرت معها.
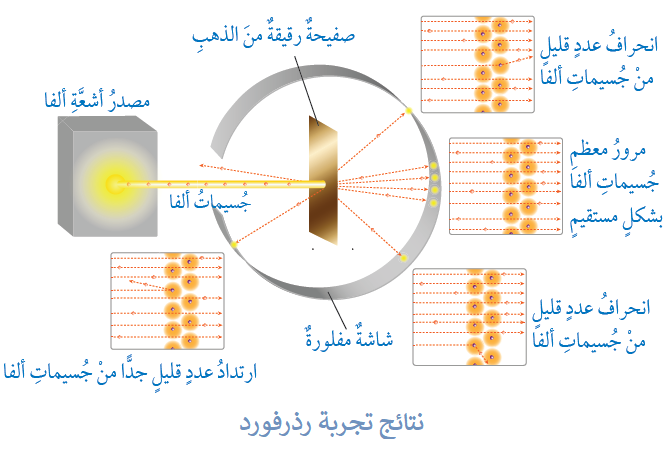
الشكل التالي يفسر مشاهدات رذرفورد:
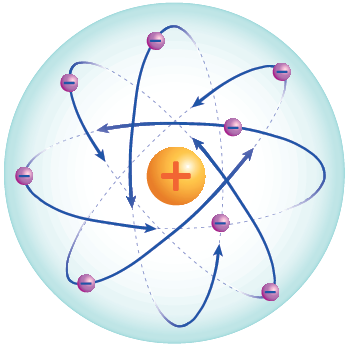
نموذج رذرفورد النووي
بعد تجربته الشهيرة على رقاقة الذهب وضع رذرفورد نموذجاً للذرة على النحو التالي:
- تتكون الذرة من نواةٍ في مركزها، وإلكترونات تدور حولها.
- شحنة النواة موجبة، وتتركز فيها معظم كتلة الذرة.
- معظم حجم الذرة فراغ.
الشكل التالي يمثل نموذجاً للذرة وفق تصور رذرفورد.
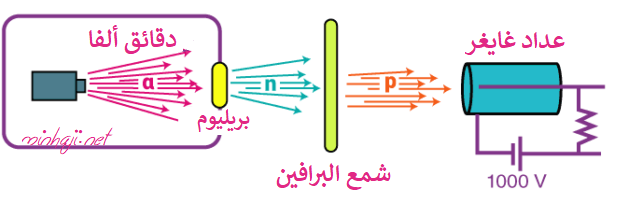
اكتشاف النيوترونات
قذف العالم شادويك صفيحة من البريليوم بجسيمات ألفا، فانطلقت منه جسيمات متعادلة سماها النيوترونات.
معلومة خارجية:
لكون النيوترونات جسيمات متعادلة، فهي لا تتأثر بالمجالين الكهربائي أو المغناطيسي، فقد سمح شادويك للنيوترونات بالمرور خلال لوح من شمع البرافين مشبع بالبروتونات، التي تحررت عند اصطدامها بالنيوترونات، وبذلك تم الكشف عن البروتونات موجبة الشحنة.
وبهذا تكون المعلومات التي توفرت عن الذرة حتى شادويك هي:
- الذرة أصغر جزء من المادة وتحمل صفاتها.
- تتكون الذرة من ثلاثة جسيمات، هي: البروتونات، والنيوترونات، والإلكترونات.
- كتلة البروتون مساوية لكتلة البروتون تقريباً.
- شحنة البروتون تساوي شحنة الإلكترون عددياً، وتخالفها في الإشارة؛ فالإلكترون سالب والبروتون موجب.
- تتركز البروتونات والنيوترونات في مركز الذرة في منطقة تسمى النواة.
- كتلة البروتون أو النيوترون تعادل كتلة (1840) إلكترون تقريباً.
- تدور الإلكترونات حول النواة في مسارات محددة.
إعداد : شبكة منهاجي التعليمية
20 / 08 / 2022
النقاشات