تنافر أزواج إلكترونات مستوى التكافؤ
Valence Shell Electrons Pair Repulsion (VSEPR)
اقترح الكيميائيون نظرية تسمى اختصاراً (VSEPR)، ويمكن من خلالها التنبؤ بأشكال الجزيئيات؛ فهي تفترض أن أزواج إلكترونات التكافؤ تترتب حول كل ذرة بحيث تكون أبعد ما يمكن ليكون التنافر فيما بينها أقل ما يمكن، فيصبح الجزيء أكثر استقراراً.
تفترض النظرية وجود خمسة أشكال أساسية للجزيئات التساهمية اعتماداً على عدد أزواج الإلكترونات الرابطة، والجدول التالي يوضح تلك الأشكال:
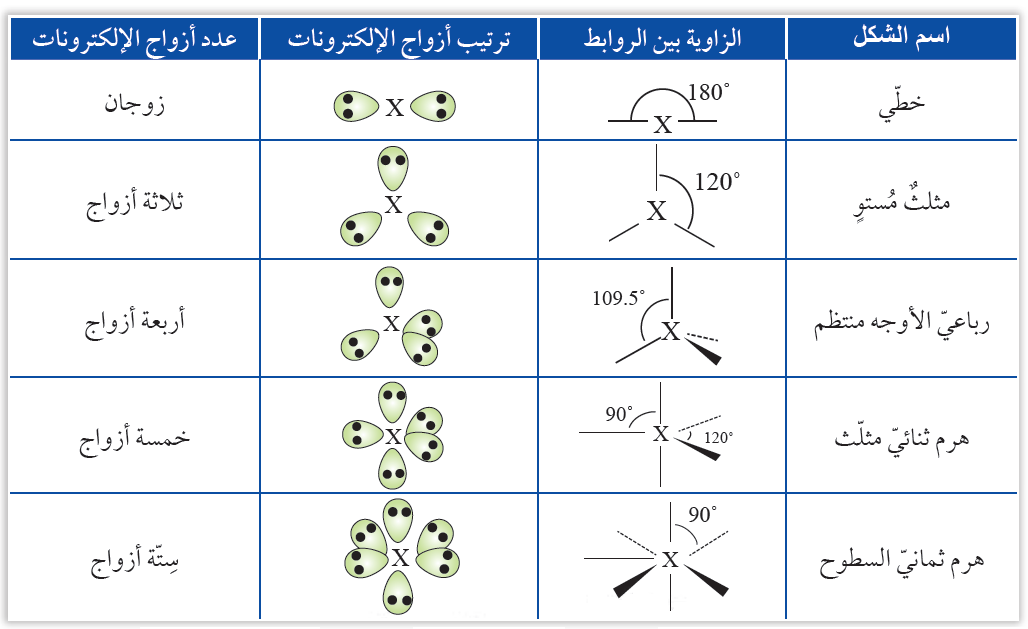
أشكال الجزيئات:
أولاً: خطي
يكون شكل الجزيء خطي إذا ارتبطت الذرة المركزية بزوجين رابطين من الإلكترونات، وتكون قيمة الزاوية بين الروابط 180ه، وتكون الصيغة العامة للجزيء AB2 .

مثال:
جزيء BeH2
4Be: 1s2 2s2
يشير التوزيع الإلكتروني لذرة البريليوم أن مستوى التكافؤ يحتوي على إلكترونين، لذا فهي تشارك بهما مع ذرتي هيدروجين لتكوين رابطتين تساهميتين، فيكون شكل الجزيء خطي.

ثانياً: مثلث مستوٍ
يكون شكل الجزيء مثلث مستوٍ إذا ارتبطت الذرة المركزية بثلاثة أزواج رابطة من الإلكترونات، وتكون قيمة الزاوية بين الروابط 120ه، وتكون الصيغة العامة للجزيء AB3 .
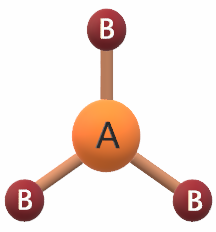
مثال:
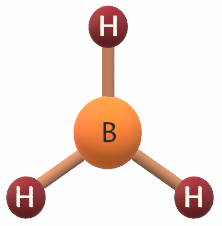
جزيء BH3
5B: 1s2 2s2 2p1
يشير التوزيع الإلكتروني لذرة البورون أن مستوى التكافؤ يحتوي على (3) إلكترونات، لذا فهي تشارك بها مع (3) ذرات هيدروجين لتكوين (3) روابط تساهمية، فيكون شكل الجزيء مثلث مستو.
ثالثاً: رباعي الأوجه منتظم
يكون شكل الجزيء رباعي الأوجه منتظم إذا ارتبطت الذرة المركزية إذا ارتبطت الذرة المركزية بأربعة أزواج من الإلكترونات الرابطة، وتكون قيمة الزاوية بين الروابط 109,5ه، وتكون الصيغة العامة للجزيء AB4 .
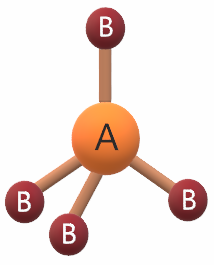
مثال:
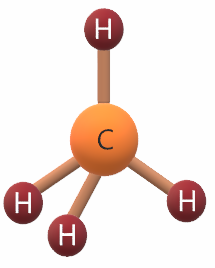
جزيء الميثان CH4
6C: 1s2 2s2 2p2
يشير التوزيع الإلكتروني لذرة الكربون أن مستوى التكافؤ يحتوي على (4) إلكترونات، لذا فهي تشارك بها مع (4) ذرات هيدروجين لتكوين (4) روابط تساهمية، فيكون شكل الجزيء رباعي الأوجه منتظم.
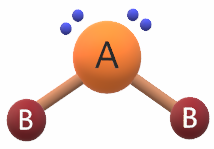
ثانياً: منحنى
إذا ارتبطت الذرة المركزية بذرتين بشرط أن تحتوي الذرة المركزية على أزواج من الإلكترونات غير رابطة، وتكون قيمة الزاوية بين الروابط 104.5 ْ تقريباً.
مثال:
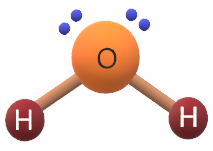
جزيء H2O
8O: 1s2 2s2 2p4
يشير التوزيع الإلكتروني لذرة الأكسجين أن غلافها الرئيس الأخير يحتوي على (6) إلكترونات، لذا فهي تشارك بإلكترونين مع ذرتي هيدروجين لتكوين رابطتين تساهميتين، ويتبقى لديها زوجين غير رابطين من الإلكترونات، فيكون شكل الجزيء منحني.
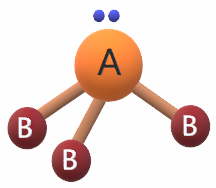
ثانياً: هرم ثلاثي
إذا ارتبطت الذرة المركزية بثلاث ذرات بشرط أن تحتوي الذرة المركزية على أزواج من الإلكترونات غير الرابطة، وتكون قيمة الزاوية بين الروابط 107,3 ْ تقريباً.
مثال:
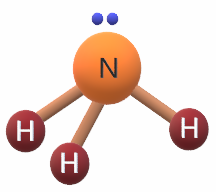
جزيء الأمونيا NH3
7N: 1s2 2s2 2p3
يشير التوزيع الإلكتروني لذرة النيتروجين أن غلافها الرئيس الأخير يحتوي على (5) إلكترونات، لذا فهي تشارك بـ (3) إلكترونات مع (3) ذرات هيدروجين لتكوين (3) روابط تساهمية، ويتبقى لديها زوج غير رابط من الإلكترونات، فيكون شكل الجزيء هرم ثلاثي.
الجدول التالي يلخص أشكال الجزيئات:
صيغة الجزيء |
الشكل البنائي |
الزاوية التقريبية |
عدد أزواج الإلكترونات غير الرابطة على الذرة A |
|
AB2 |
خطي |
180ه |
_ |
|
منحني (زاوي) |
104,5ه |
زوجين |
|
|
AB3 |
مثلث مسطح |
120ه |
_ |
|
هرم ثلاثي |
107,3ه |
زوج |
|
|
AB4 |
رباعي الأوجه منتظم |
109,5ه |
_ |
سؤال (1):
مستعيناً بالجدول الدوري وتراكيب لويس، حدّد الأشكال الفراغية لكل من الجزيئات التالية:
CO2 , PF3 , H2S
الإجابة:
- الشكل الهندسي لـ H2S هو منحني.
- الشكل الهندسي لـ PF3 هو هرم ثلاثي.
- الشكل الهندسي لـ CO2 هو خطي.
سؤال (2):
قارن بين الجزيئين: BF3 و NF3 من حيث:
( العدد الذري للبورون = 5 , وللنتروجين = 7 , وللفلور = 9 )
1- الشكل البنائي.
2- قيمة الزاوية بين الروابط.
3- عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية.
4- عدد أزواج الإلكترونات غير الرابطة في الجزيء.
الإجابة:
|
الرقم |
BF3 |
NF3 |
|
1 |
مثلث مسطح |
هرم ثلاثي |
|
2 |
120 |
107,5 |
|
3 |
لا يوجد |
زوج |
|
4 |
9 |
10 |
سؤال (3):
قارن بين الجزيئين : BeF2 ، PF3 من حيث: (العدد الذري لـ Be = 4 ،F = 9 ،P = 15).
- الشكل الهندسي.
- الزاوية بين روابطهما.
- عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية.
- عدد أزواج الإلكترونات الرابطة في كل جزيء.
الإجابة:
|
الرقم |
BeF2 |
PF3 |
|
1 |
خطي |
هرم ثلاثي |
|
2 |
120 |
107,5 |
|
3 |
لا يوجد |
زوج |
|
4 |
زوجين |
ثلاثة أزواج |
سؤال (4):
يتحد كل من العنصرين: 16D , 4Q مع العنصر 9M فيتكون جزيئين، قارن بينهما من حيث:
- الشكل الهندسي.
- مقدار الزاوية بين الروابط.
- عدد أزواج الإلكترونات غير الرابطة على الذرة المركرية.
- عدد أزواج الإلكترونات غير الرابطة في الجزيء.
الإجابة:
|
الرقم |
QM2 |
DM2 |
|
1 |
منحني |
خطي |
|
2 |
104,5 |
120 |
|
3 |
زوجين |
لا يوجد |
|
4 |
8 أزواج |
6 أزواج |
إعداد : شبكة منهاجي التعليمية
03 / 07 / 2024
النقاشات