الرابطة التساهمية الثلاثية
تنشأ الرابطة التساهمية الثلاثية عندما تتشارك ذرتان بثلاثة أزواج رابطة من الإلكترونات.
مثال (1):
أكتب تركيب لويس لجزيء N2 ، وأحدد عدد أزواج الإلكترونات الرابطة وغير الرابطة في الجزيء. (العدد الذري لذرة N = 7).
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرة النيتروجين:

ثانياً: أحدد عدد الإلكترونات المتوفرة (v.e) لجميع ذرات الجزيء:
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ N × عدد ذراته)
Total (v.e) = (5 x 2) = 10e-
ثالثاً: أحسب عدد أزواج الإلكترونات المتوفرة (v.e.p):
n(v.e.p) = = 5
رابعاً: أرسم رابطة أحادية بين ذرتي النيتروجين:

خامساً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 5 – 1 = 4
سادساً: أوزع الأزواج المتبقية على ذرتي النيتروجين:
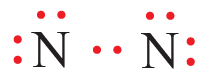
لاحظ أن قاعدة الثمانية لم تتحقق لذرتي النيتروجين؛ لذا نحول زوج غير رابط من كل ذرة نيتروجين إلى زوج رابط من الإلكترونات، فتصبح الرابطة بين ذرتي النيتروجين ثلاثية، ويتبقى على كل ذرة زوج غير رابط من الإلكترونات.

- عدد أزواج الإلكترونات الرابطة: (3) أزواج.
- عدد أزواج الإلكترونات غير الرابطة على كل ذرة نيتروجين: (1) زوج.
- عدد أزواج الإلكترونات غير الرابطة في الجزيء: (2) زوج.
مثال (2):
أكتب تركيب لويس لجزيء الأستيلين C2H2 . (العدد الذري لذرة C = 6 ، وللذرة H = 1 ).
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرات الجزيء:
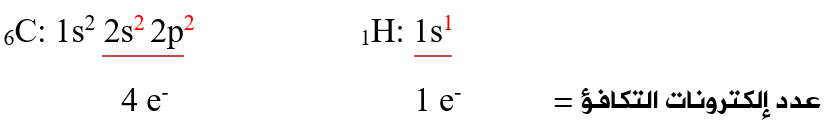
ثانياً: أحسب عدد إلكترونات التكافؤ الكلي لجميع ذرات الجزيء:
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ C × عدد ذراته) + (عدد إلكترونات تكافؤ H × عدد ذراته)
Total (v.e) = (4 x 2) + (1 x 2) = 10e-
ثالثاً: أحسب عدد أزواج إلكترونات التكافؤ (v.e.p):
n(v.e.p) = = 5
رابعاً: أوزع ذرتي H حول الذرتين المركزيتين C ، وأرسم رابطة أحادية بين ذرات الكربون وذرات الهيدروجين، ورابطة أحادية بين ذرتي الكربون، وتمثل كل رابطة زوج رابط من الإلكترونات (b.e.p).

خامساً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 5 – 3 = 2
الزوجين المتبقيين من الإلكترونات يتم تحويلهما إلى زوجين رابطين بين ذرتي الكربون لتتحقق قاعدة الثمانية، فتصبح الرابطة بين ذرتي الكربون ثلاثية.

إعداد : شبكة منهاجي التعليمية
03 / 07 / 2024
النقاشات