التبخر
Evaporation
مفهوم التبخر
التبخر: تحول المادة من الحالة السائلة إلى الحالة الغازية.
يحدث التبخر على سطح السائل، وعند أي درجة حرارية.

تفسير عملية التبخر
كي تحدث عملية التبخر يجب أن تمتلك جزيئات السائل الموجودة على سطحه حد أدنى من الطاقة للتغلب على قوى التجاذب بين جزيئات السائل، وبفعل الحركة الدائمة والعشوائية لجزيئات السائل يحدث تصادم بين تلك الجزيئات، فتمتلك بعض الجزيئات طاقة كافية للتغلب على قوى التجاذب فتفلت من سطح السائل وتتبخر.
تفسير عملية تبخر السائل تبعاً لمنحنى ماكسويل – بولتزمان
الشكل التالي يمثل منحنى ماكسويل – بولتزمان لتوزيع الطاقة الحركية لجزيئات سائل عند درجة حرارة معينة:
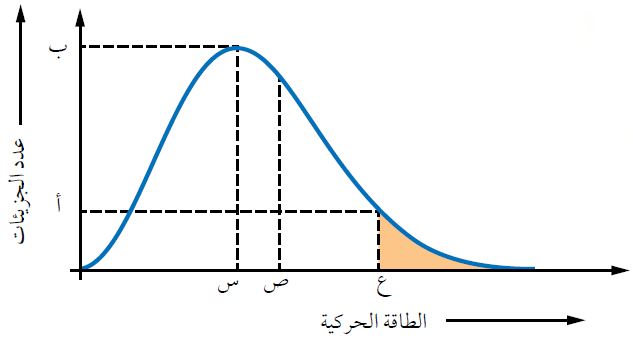
تمثل الرموز:
(س): الطاقة الحركية التي يمتلكها أكبر عدد من جزيئات السائل.
(ب): عدد الجزيئات التي تمتلك الطاقة الحركية (س).
(ص): متوسط الطاقة الحركية للجزيئات.
(ع): الحد الأدنى من الطاقة اللازمة للتغلب على قوى التجاذب بين جزيئات السائل، لتتحول إلى الحالة الغازية.
(أ): عدد الجزيئات التي تمتلك الحد الأدنى من الطاقة للتغلب على قوى التجاذب.
المساحة المظللة: عدد الجزيئات التي تمتلك طاقة للتبخر، فتفلت من سطح السائل وتتبخر.
يحدث التبخر عندما تتصادم جزيئات السائل مع بعضها، وقد يصدف أن تكتسب بعض جزيئات السائل الموجودة على السطح بفعل التصادم طاقة كافية للتغلب على قوى التجاذب بين جزيئاتها، أي تمتلك الحد الأدنى من الطاقة للتغلب على قوى التجاذب، فيفلت من سطح السائل ويتبخر.
العوامل المؤثرة في سرعة التبخر
أولاً: قوى التجاذب
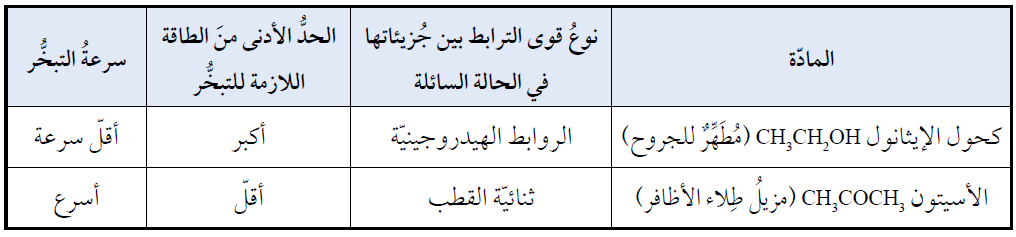
السوائل التي تمتلك جزيئاتها قوى تجاذب ضعيفة أسرع تبخراً من السوائل التي تمتلك جزيئاتها قوى تجاذب قوية، لأن الحد الأدنى من الطاقة اللازمة للتغلب على قوى التجاذب بين جزيئاتها أقل.
مثال:
الأسيتون CH3COCH3 أسرع تبخراً من الإيثانول CH3CH2OH .
يعود السبب في ذلك إلى أن جزيئات الإيثانول تترابط جزيئاتها بروابط هيدروجينية أقوى من قوى ثنائية القطب الموجودة بين جزيئات الأسيتون، وهذا يعني أن الطاقة اللازمة للتغلب على قوى التجاذب في الإيثانول أكبر من الأسيتون، فتقل سرعة تبخره.
سؤال:
أرتب السوائل الآتية تصاعدياً تبعاً لتزايد سرعة تبخرها:
CH3CH2CH3 , CH3CH2OH , CH3CH2Cl
تترابط جزيئات CH3CH2CH3 بقوى لندن الضعيفة.
تترابط جزيئات CH3CH2Cl بقوى ثنائية القطب الأقوى من قوى لندن.
تترابط جزيئات CH3CH2OH بروابط هيدروجينية الأقوى من قوى ثنائية القطب.
وبزيادة قوى التجاذب تقل سرعة تبخر السائل، وعليه يكون ترتيب الجزيئات تبعاً سرعة تبخرها:
CH3CH2OH < CH3CH2Cl < CH3CH2CH3
ثانياً: درجة الحرارة
تزداد سرعة تبخر السائل بزيادة درجة الحرارة، فبزيادة درجة الحرارة تزداد الطاقة الحركية للجزيئات، وهذا يزيد من عدد التصادمات بينها، فيزداد عدد الجزيئات التي تمتلك الحد الأدنى من الطاقة اللازمة للتبخر، وتزداد سرعة التبخر.
تفسير أثر الحرارة في التبخر تبعاً لمنحنى ماكسويل – بولتزمان
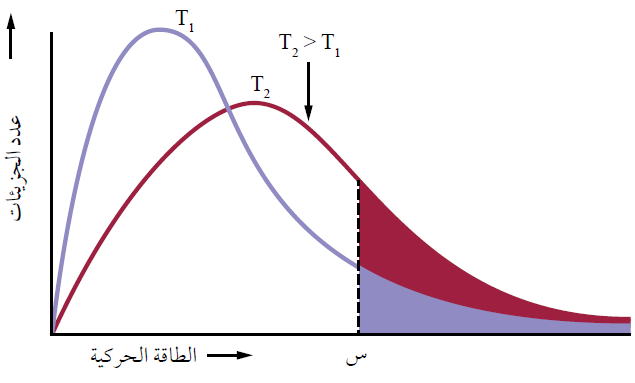
لاحظ من خلال منحنى ماكسويل – بولتزمان أن زيادة درجة الحرارة لا يؤثر في الحد الأدنى من الطاقة اللازمة للتغلب على قوى التجاذب (س)، ولكنه زاد من المساحة المظللة؛ أي أن رفع درجة الحرارة زاد من عدد الجزيئات التي تمتلك الحد الأدنى من الطاقة اللازمة للتبخر، فتزداد سرعة التبخر.
طاقة التبخر المولية
تُسمى الطاقة اللازمة لتبخير مول واحد من السائل بطاقة التبخر المولية.
طاقة التبخر المولية: كمية الطاقة اللازمة لتبخير مول واحد من السائل عند درجتي حرارة وضغط ثابتين.
تمثل عملية تبخر مول من الماء بالمعادلة الآتية:
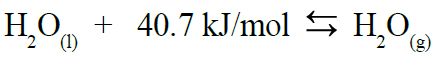
تعتبر طاقة التبخر المولية للماء عالية مقارنة بطاقة التبخر المولية للسوائل الأخرى؛ بسبب الروابط الهيدروجينية القوية بين جزيئاته والتي ترفع من طاقة تبخره المولية.
تزداد طاقة التبخر المولية للسائل بزيادة قوى التجاذب بين جزيئاته.
أتحقق صفحة (82):
1- ما العلاقة بين طاقة التبخر المولية للسائل وقوى التجاذب بين جزيئاته؟
تزداد طاقة التبخر المولية للسائل بزيادة قوى التجاذب بين جزيئاته.
2- أرتب السوائل الآتية تصاعدياً تبعاً لتزايد سرعة تبخرها:
CH3CH3 , CH3OH , CH3Cl
CH3OH < CH3Cl < CH3CH3
أفكر صفحة (82):
يمثل الشكل توزيع الطاقة الحركية لجزيئات السائلين A و B عند درجة حرارة معينة.
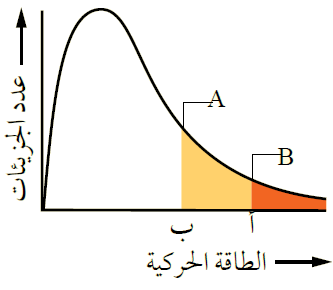
- ماذا تمثل كل من النقطتين أ و ب ؟
(أ) الحد الأدنى من الطاقة اللازمة للتغلب على قوى التجاذب بين جزيئات السائل B فيتبخر.
(ب) الحد الأدنى من الطاقة اللازمة للتغلب على قوى التجاذب بين جزيئات السائل A فيتبخر.
- أي السائلين أسرع تبخراً عند درجة الحرارة نفسها؟
السائل A أسرع تبخراً؛ لأن الحد الأدنى من الطاقة اللازمة لتبخره أقل.
إعداد : أ. أحمد الحسين
23 / 11 / 2022
النقاشات