التكاثف
Condensation
مفهوم التكاثف
التكاثف: عملية تحول المادة من الحالة الغازية إلى الحالة السائلة.
التكاثف عملية معاكسة للتبخر، ولحدوث عملية التكاثف يجب توفر شرطين، هما:
- انخفاض درجة الحرارة (التبريد) لتقليل الطاقة الحركية للجزيئات.
- تقارب الجزيئات.
تفسير حدوث عملية التكاثف
عندما تنخفض درجة حرارة البخار تقل الطاقة الحركية لجزيئاته وتقل سرعتها، وعندما تتقارب الجزيئات تتجاذب الجزيئات متحولة إلى الحالة السائلة.
طاقة التكاثف المولية
تُسمى الطاقة الناتجة من تكاثف مول واحد من الغاز بطاقة التكاثف المولية.
طاقة التكاثف المولية: الطاقة الناتجة من تحويل مول واحد من جزيئات المادة من الحالة الغازية إلى الحالة السائلة، في درجة الحرارة نفسها.
العلاقة بين طاقة التبخر وطاقة التكاثف
طاقة التبخر تساوي مقداراً طاقة التكاثف للمادة نفسها، إلا أن طاقة التكاثف هي طاقة منبعثة، وطاقة التبخر طاقة ممتصة.
مثال:
المعادلة التالية تمثل طاقة التبخر المولية للماء:
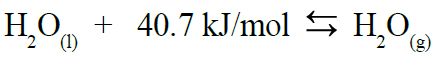
المعادلة التالية تمثل طاقة التكاثف المولية للماء:
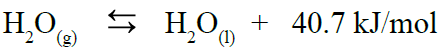
أفكر صفحة (83):
أفسر، مستعيناً بالشكل الآتي:
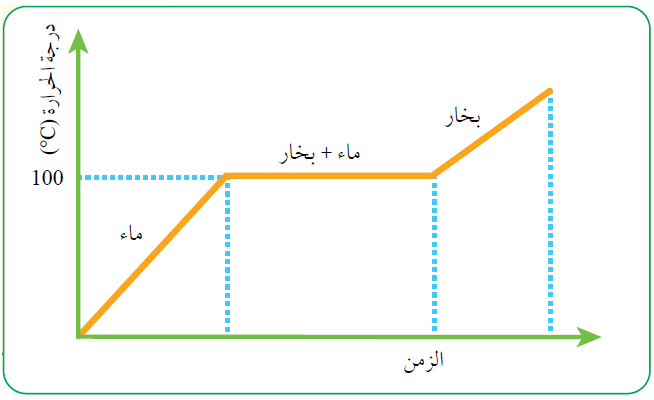
الحروق الناجمة عن بخار الماء أشدّ من تلك الناجمة عن الماء الساخن عند درجة حرارة 1000C.
نلاحظ من المنحنى ارتفاع درجة حرارة الماء نتيجة تسخينه حتى 1000C ثم ثبات هذه الدرجة لفترة من الزمن مع استمرار التسخين، فيمتص الماء مزيداً من الطاقة الحرارية للتغلب على قوى التجاذب بين جزيئاته متحولاً إلى بخار الماء، أي أن بخار الماء يختزن كمية من الطاقة الحرارية أكبر من تلك التي يختزنها الماء عند 1000C وعند تكاثفه فإنه يطلقها مسبباً حروقاً أشد من تلك التي يسببها الماء على درجة حرارة 1000C .
أتحقق صفحة (83):
ما شروط حدوث عملية التكاثف؟
انخفاض درجة الحرارة، وتقارب الجزيئات.
إعداد : أ. أحمد الحسين
11 / 11 / 2021
النقاشات