أسئلة المحتوى وإجاباتها
الحالة الغازية
أفكر صفحة (56):
أي الغازين Ne أم NH3 تتوقع أن يكون أقرب في سلوكه إلى الغاز المثالي عند الظروف نفسها؟
غاز Ne أقرب في سلوكه إلى الغاز المثالي؛ لأنه جسيماته تترابط بقوى لندن الضعيفة، بينما جزيء NH3 قطبي وتترابط جزيئاته بروابط هيدروجينية قوية نسبياً، وكلما قلت قوى التجاذب بين جزيئات الغاز اقترب سلوكه من الغاز المثالي.
أتحقق صفحة (53):
ما الظروف التي يكون سلوك الغاز الحقيقي عندها أقرب إلى سلوك الغاز المثالي؟
يقترب الغاز الحقيقي من السلوك المثالي عندما ترتفع درجة حرارته، فتتباعد جزيئاته وتقل قوى التجاذب بينها، وعندما يقل الضغط الواقع على الغاز تتباعد الجزيئات وتقل قوى التجاذب بين جزيئاته، كما أن طبيعة الغاز نفسه تؤثر في اقترابه من السلوك المثالي، فالغازات التي تتجاذب بقوى لندن أقرب للغازات التي تتجاذب جزيئاتها بقوى ثنائية القطب أو روابط هيدروجينية.
أتحقق صفحة (59):
عينة من غاز محصور حجمها 4 L عند ضغط 2 atm ، سُمح لها بالتمدد حتى أصبح حجمها 12 L. احسب ضغطها عند درجة الحرارة نفسها.
تحليل السؤال (المعطيات)
قبل حل السؤال يجب أن تكون وحدات الحجم متجانسة.
P1 = 2 atm
P2 = ??
V1 = 4 L
V2 = 12 L
الحل:
P1 V1 = P2 V2
2 x 4 = P2 x 12
P2 = 0.66 atm
أتحقق صفحة (61):
عينة من غاز النيتروجين حجمها 430 mL عند 24oC ، عند أي درجة حرارة يصبح حجمها 0.75 L بفرض ثبات الضغط؟
تحليل السؤال (المعطيات)
T1 = 24 + 273 = 297 K
T2 = ??
V1 = 430 mL = 0.43 L
V2 = 0.75 L
الحل:
V1 / T1 = V2 / T2
0.43 / 297 = 0.75 / T2
T2 = 518 K
T2 = 518 – 273 = 245oC
أتحقق صفحة (63):
إذا كان ضغط الهواء داخل إطار سيارة 1.85 atm عند 270C ، وبعد قيادتها لمسافة معينة أصبح 2.2 atm ، فاحسب درجة حرارته، بفرض ثبات حجمه.
تحليل السؤال (المعطيات)
T1 = 27 + 273 = 300 K
T2 = ??
P1 = 1.85 atm
P2 = 2.2 atm
الحل:
P1 / T1 = P2 / T2
1.85 / 300 = 2.2 / T2
T2 = 356.75 K
T2 = 356.75 – 273 = 83.750C
أفكر صفحة (67):
كيف يتغير ضغط الغاز عند زيادة عدد مولاته مع بقاء حجمه ودرجة حرارته ثابتين؟
زيادة عدد مولات الغاز يزيد من عدد جسيماته، ومن ثم تزداد عدد تصادماتها مع جدار الإناء فيزداد الضغط.
أتحقق صفحة (67):
ما الحجم الذي يشغله 3.5 mol من غاز الكلور Cl2 في الظروف المعيارية؟
تحليل السؤال (المعطيات)
في الظروف المعيارية يكون حجم مول من الغاز 22.4 L
الحل:
V2 = n x V
V2 = 3.5 x 22.4 = 78.4 L
أفكر صفحة (68):
هل تتغير قيمة ثابت الغاز العام إذا تغيرت الوحدة المستخدمة في قياس الضغط؟ فسّر ذلك.
الحل:
قانون الغاز المثالي:
PV = nRT
R = 0.082 L.atm/mol.k
وبما أن وحدة قياس الضغط المستخدمة عند حساب القيمة السابقة هي ضغط جوي:
1 atm = 101.3 KPa = 760 mmHg
فإن قيمة R ستتغير إذا استخدمت وحدة أخرى كالكيلوباسكال أو المليمتر زئبق لقياس الضغط.
ويمكن إيجاد قيمة أخرى لـ R اعتماداً على حجم المول الواحد من الغاز والذي يساوي 22.4 L في الظروف المعيارية (101.3 KPa , 00C) أو (760 mmHg , 00C)، وبالتعويض في قانون الغاز المثالي:
R = (22.4L x 101.3KPa) / (1mol x 273k) = 8.31 L.KPa/mol.K
R = (22.4L x 760mmHg) / (1mol x 273k) = 62.36 L.mmHg/mol.K
أتحقق صفحة (69):
تعبأ كرات التنس بغاز النيتروجين. احسب عدد مولات الغاز في كرة حجمها 0.15 L وضغط الغاز داخلها 2 atm عند درجة 250C .
تحليل السؤال (المعطيات)
n = ??
V = 0.15 L
P = 2 atm
T = 25 + 273 = 298 K
R = 0.082 L.atm/mol.K
الحل:
PV = n RT
2 x 0.15 = n x 0.082 x 298
n = 0.012 mol
أتحقق صفحة (74):
إذا علمت أن 2 L من غاز النيتروجين N2 ضغطه 0.395 atm و 2 L من غاز الهيدروجين H2 ضغطه 0.11 atm خلطت في وعاء واحد حجمه 1 L ، فاحسب الضغط الكلي للخليط.
تحليل السؤال (المعطيات)
بما أن حجم كل من الغازين قل إلى النصف، فإن ضغط كل منهما سيزداد إلى الضعف.
الحل:
PN2 = 2 x 0.395 = 0.79 atm
PH2 = 2 x 0.11 = 0.22 atm
PT = 0.79 + 0.22 = 1.01 atm
طريقة أخرى للحل:
يمكن حساب الضغط الجزئي لكل غاز من قانون بويل، ثم جميع الضغطين الناتجين.
أتحقق صفحة (76):
ما نسبة سرعة انتشار غاز الهيدروجين (H2) إلى سرعة انتشار غاز ثاني أكسيد الكربون (CO2) عند الظروف نفسها.
تحليل السؤال (المعطيات)
MrH2 = 2 g/mol
MrCO2 = 44 g/mol
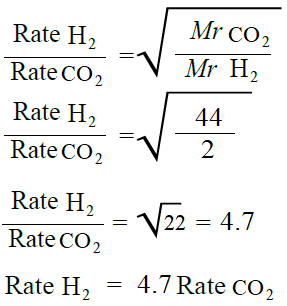
إعداد : شبكة منهاجي التعليمية
02 / 11 / 2022
النقاشات