تفاعلات التأكسد والاختزال
Oxidation Reduction Reactions
تُعد تفاعلات التأكسد والاختزال من التفاعلات المهمة في حياتنا، ومن بين استخداماتها:
- تُستخدم في استخلاص الفلزات من خاماتها.
- تُستخدم في البطاريات، كبطارية السيارة وبطاريات الهاتف المحمول والساعات وغيرها.
- يُستفاد منها في إنتاج الطاقة داخل أجسام الكائنات الحيّة.
ولكن ما المقصود بكلّ من التأكسد والاختزال؟
التعريف القديم للتأكسد والاختزال
اشتقت كلمة تأكسد في الأصل من تفاعل العنصر مع الأكسجين.
التأكسد: اتحاد العناصر مع الأكسجين لتكوين الأكسيد.
الاختزال: نزع الأكسجين من خامات أكاسيد الفلزات.
مثال (1):
تفاعل الحديد مع الأكسجين لإنتاج أكسيد الحديد.
4Fe + 3O2 → 2Fe2O3
لاحظ من خلال التفاعل أن الحديد قد اتحد مع الأكسجين، لذا نقول أن الحديد قد تأكسد.

مثال (2):
تفاعل أكسيد الحديد مع الكربون.
4Fe + 3CO2 → 2Fe2o3 + 3C
لاحظ من التفاعل أن الكربون اتحد مع الأكسجين، لذا نقول أن الكربون قد تأكسد، والحديد قد نُزع منه الأكسجين، لذا نقول أنه اختُزل.
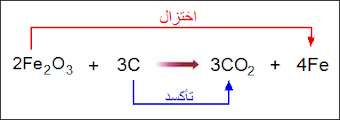
إلا أن هذا التعريف لا ينطبق على الكثير من التفاعلات، لأن كثيراً منها لا يتضمن تفاعل العنصر مع الأكسجين، لذا تمّ اقتراح تعريف جديد للتأكسد والاختزال.
التعريف الحديث للتأكسد والاختزال
التأكسد: عملية فقد المادة للإلكترونات خلال التفاعل.
الاختزال: عملية كسب المادة للإلكترونات خلال التفاعل.
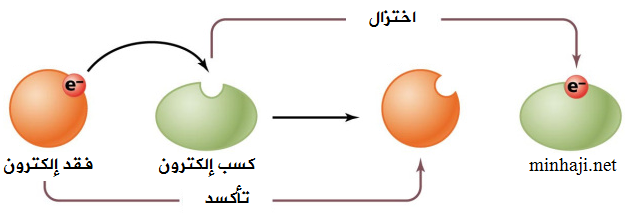
يتضمن تفاعل التأكسد والاختزال جزأين، هما:
- تفاعل التأكسد، وتوضع فيه الإلكترونات مع النواتج (فقد إلكترونات).
- تفاعل الاختزال، وتوضع فيه الإلكترونات مع المتفاعلات (كسب إلكترونات).
ولا يحدث تفاعل التأكسد دون أن يرافقه تفاعل اختزال؛ لأن المادة لا تتأكسد (تفقد إلكترونات) إلا إذا تفاعلت مع مادة تميل للاختزال (كسب الإلكترونات).
مثال:
التفاعل الآتي يمثل تفاعل تأكسد واختزال:
Zn + Cu2+ → Zn2+ + Cu
يتضمن هذا التفاعل، تفاعل تأكسد، وتفاعل اختزال:
Zn → Zn2+ + 2e تفاعل تأكسد
Ni2+ + 2e → Ni تفاعل اختزال
وللتميز بين التأكسد والاختزال من المفيد أن تحفظ الشحنات التي تكونها بعض العناصر في تفاعلاتها، وهي موضحة في الجدول التالي:
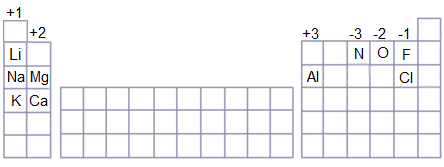
لاحظ أن شحنة العنصر في مركباته يمكن اشتقاقها من رقم مجموعة العنصر في الجدول الدوري.
- شحنة عناصر المجموعة الأولى = +1
- شحنة عناصر المجموعة الثانية = +2
- شحنة عناصر المجموعة الثالثة = +3
- شحنة عناصر المجموعة الخامسة = -3
- شحنة عناصر المجموعة السادسة = -2
- شحنة عناصر المجموعة السابعة = -1
مثال:
لاحظ كيف نحدد عمليتي التأكسد والاختزال في التفاعل التالي:
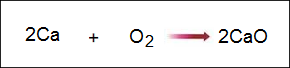
الكالسيوم الموجود في المتفاعلات شحنته (صفر) لأنه لم يتفاعل بعد.
الأكسجين الموجود في المتفاعلات شحنته (صفر) لأنه لم يتفاعل بعد.
بما أن الكالسيوم من المجموعة الثانية، لذا فإن شحنته تصبح عندما يتفاعل مع الأكسجين (+2)، أي أنه يميل لفقد إلكترونين.
بما أن الأكسجين من المجموعة السادسة، لذا فإن شحنته تصبح عندما يتفاعل مع الكالسيوم (-2)، أي أنه يميل لكسب إلكترونين من الكالسيوم.

وعليه نقول أن الكالسيوم قد تأكسد (فقد إلكترونات)، والأكسجين قد اختُزل (اكتسب إلكترونات).

سؤال:
تأمل المعادلتين الآتيتين، ثم أجب عن الأسئلة التي تليهما:
Ca + Ni2+ → Ca2+ + Ni
Al + Fe(NO3)3 → Al(NO3)3 + Fe
- عين الذرات التي تأكسدت والذرات التي اختزلت في كل من المعادلتين.
- ما عدد الإلكترونات المفقودة والمكتسبة في عمليتي التأكسد والاختزال في كلٍّ من المعادلتين؟
الحل:
- الذرات التي تأكسدت والذرات التي اختزلت في المعادلتين:
في المعادلة الأولى:
الذرة التي تأكسدت هي (Ca)، واختزلت أيونات (Ni2+).
في المعادلة الثانية:
الذرة التي تأكسدت هي (Al)، واختزلت أيونات (Fe3+).
- عدد الإلكترونات المكتسبة أو المفقودة في المعادلة الأولى = 2 ، وفي المعادلة الثانية = 3
إعداد : شبكة منهاجي التعليمية
24 / 04 / 2020
النقاشات