الخلايا الغلفانية
Galvanic Cells
الخلايا الغلفانية: جهاز يحتوي على مادة كهرلية وقطبين، يحدث فيها تفاعل كيميائي (تلقائي) تتحول فيه الطاقة الكيميائية إلى طاقة كهربائية.
صفات الخلية الغلفانية:
- يحدث فيها تفاعل تأكسد واختزال تلقائي.
- تنتج طاقة كهربائية.
- تحولات الطاقة فيها من طاقة كيميائية إلى طاقة كهربائية.
- تحتوي على قطبين، أحدهما يسمى مصعداً (-)، ويحدث عنده تفاعل التأكسد، والآخر يسمى مهبطاً (+) ويحدث عنده تفاعل الاختزال.
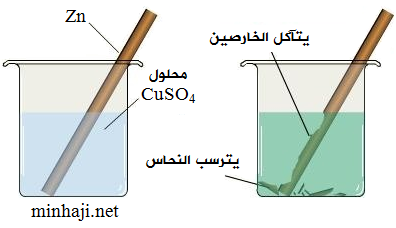
خلية غلفانية في وعاءٍ واحد
يمكن تكوين خلية غلفانية في وعاء واحد يحدث فيه تفاعل التأكسد والاختزال، وتنقل فيها الإلكترونات مباشرةً داخل داخل الوعاء.
مثال:
عند وضع صفيحة من الخارصين Zn في محلول كبريتات النحاس ZnSO4 .
تتأكسد ذرات الخارصين وتفقد إلكترونين وتتحول إلى أيونات Zn2+ تذوب في المحلول.
Zn2+ + 2e → Zn
تكتسب أيونات النحاس Cu2+ الإلكترونين (تختزل) وتتحول إلى ذرات تترسب على صفيحة الخارصين.
Cu → Cu2+ + 2e
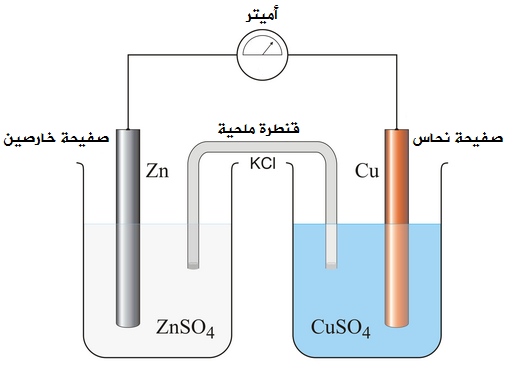
خلية غلفانية في وعائين
ويحدث في هذا النوع من الخلايا الغلفانية تفاعل تأكسد واختزال، وتنقل فيها الإلكترونات عبر سلك موصل.
مثال:
الخلية الغلفانية المكونة من قطب خارصين وقطب نحاس.
لعمل هذا الخلية في وعائين نقوم بالإجراءات التالية:
- نضع صفيحة من الخارصين في وعاء يحتوي على محلول كبريتات الخارصين.
- نضع صفيحة من النحاس في وعاء يحتوي على محلول كبريتات النحاس.
- نصل الصفيحتين معاً بسلك وأميتر.
- نصل المحلولين معاً بأنبوب زجاجي يحتوي على محلول مشبع من مادة أيونية مثل KCl ويسمى هذا الأنبوب القنطرة الملحية.
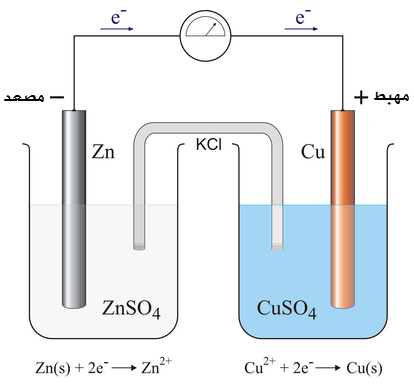
مبدأ عمل الخلية
بما أن الخارصين أكثر نشاطاً من النحاس حسب سلسلة النشاط الكيميائي، لذا فعلى قطب الخارصين ستحدث عملية التأكسد، لذا فهو يمثل المصعد في هذه الخلية، وشحنة القطب (-)، وسيحدث الاختزال عند قطب النحاس، ويمثل قطب النحاس المهبط وشحنة القطب (+).
يحدث تأكسد عند قطب الخارصين ويفقد إلكترونين، ويتحول إلى أيونات Zn2+ تذوب في المحلول.
Zn2+ + 2e → Zn
تتحرك الإلكترونات من قطب الخارصين، عبر الأسلاك والأميتر باتجاه قطب النحاس.
تكتسب أيونات النحاس Cu2+ الموجودة في المحلول وتتحول إلى ذرات تترسب على قطب النحاس.
Cu → Cu2+ + 2e
وحتى تكتمل الدارة الكهربائية تتحرك السالبة من الوعاء الذي تحدث فيه عملية الاختزال إلى الوعاء الذي تحدث فيه عملية التأكسد، وتتحرك الأيونات الموجبة من من الوعاء الذي تحدث فيه عملية التأكسد إلى الوعاء الذي تحدث عنده عملية الاختزال.
سؤال:
خلية غلفانية قطباها من النحاس Cu والنيكل Ni ، وتحتوي على محلولي كبريتات النحاس CuSO4 وكبريتات النيكل NiSO4 بتركيز 1 مول/لتر. فإذا علمت أن النيكل أكثر نشاطاً من النحاس. فأجب عن الأسئلة الآتية:
- أي القطبين يمثل المصعد، وأيهما يمثل المهبط؟
- ما التفاعل الذي يحدث على قطب النحاس؟ اكتب معادلة التفاعل.
- ما التفاعل الذي يحدث على قطب النيكل؟ اكتب معادلة التفاعل.
- اكتب معادلة التفاعل الكلي الذي يحدث في هذه الخلية.
- حدد اتجاه حركة الإلكترونات عبر السلك بين القطبين.
الحل:
- المصعد هو قطب النيكل، والمهبط هو قطب النحاس.
- يحدث على قطب النيكل تفاعل تأكسد:
Ni2+ + 2e → Ni
- وفي محلول النحاس يحدث تفاعل اختزال:
Cu2+ + 2e → Cu
- التفاعل الكلي:
Ni + Cu2+ → Ni2+ + Cu
- تتجه الإلكترونات من قطب النيكل إلى قطب النحاس.
إعداد : شبكة منهاجي التعليمية
24 / 04 / 2020
النقاشات