تطبيقات الخلايا الغلفانية
تعد البطاريات تطبيقاً عملياً على الخلايا الغلفانية، ولعمل بطارية يلزم توفر شرطين، هما:
- فلزان مختلفان في قابليتهما لفقد الإلكترونات.
- محلول لمادة موصلة للتيار الكهربائي (محلول كهرلي).
خلية الليمون
يمكن إنتاج تيار كهربائي من حبة ليمون طرية، وصفيحتين من فلزين مختلفين؛ كالخارصين والنحاس.
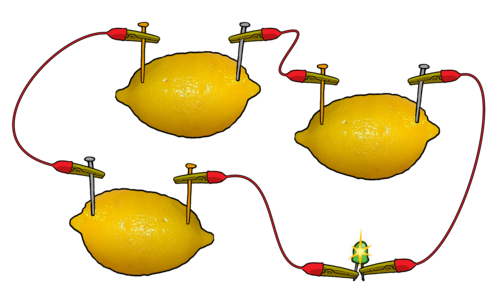
إلا أن قيمة فرق الجهد الناتج من بطارية الليمون لا تتجاوز قيمته (1) فولت، ويمكن لهذا الجهد أن يشغل ساعة.
البطارية الجافة Dry Battery
سنة اختراعها: عام 1866م.
أشهر أنواعها: بطارية (الغرافيت والخارصين).
فرق الجهد الذي تعطيه البطارية: في حدود 1.5 فولت.
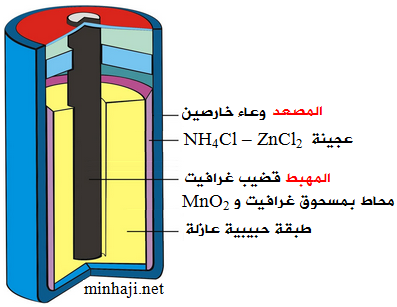
أجزاء البطارية الجافة:
أ- مهبط (+): يتكون من قضيب من الغرافيت (كربون) محاط بخليط من مسحوق الغرافيت وثاني أكسيد المنغنيز MnO2 .
ب- مصعد (-): وعاء أسطواني من فلز الخارصين.
ج- مادة كهرلية: وتتكون من عجينة من كلوريد الأمونيوم NH4Cl وكلوريد الخارصين ZnCl2 .
د- طبقة عازلة تغلف أسطوانة الخارصين من الداخل والخارج.
التفاعلات التي تحدث في البطارية الجافة:
تفاعل المصعد:
Zn → Zn2+ + 2e-
تفاعل المهبط:
2NH4+ + 2MnO2 + 2e- → Mn2O3 + H2O + 2NH3
عيوب بطارية (الغرافيت والخارصين):
- يتناقص فرق جهدها مع الوقت.
- عمرها قصير.
- لا يمكن إعادة شحنها.
- تتلف بسرعة في الجو البارد.
بطارية المركم الرصاصي Lead Storage Battery
استخداماتها: تُستخدم في السيارات.
فرق الجهد الذي تعطيه البطارية: 12 فولت، فهي تحتوي على (6) خلايا.
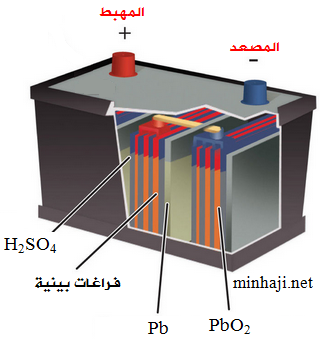
أجزاء المركم الرصاصي:
أ- مهبط (+): أكسيد الرصاص PbO2 .
ب- مصعد (-): رصاص Pb .
ج- المحلول الكهرلي: حمض الكبريتيك H2SO4 .
التفاعل الكلي في المركم الرصاصي:
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
مميزات المركم الرصاصي:
- تتألف من 6 خلايا، كل خلية منها تعطي (2) فولت.
- يمكن إعادة شحنها بإعطائها طاقة كهربائية تعكس التفاعل.
- عمرها أطول من البطارية الجافة.
سؤال:
نظم في دفترك جدولاً للمقارنة بين نوعي البطاريات السابقتين كالآتي:
|
وجه المقارنة |
خلية الغرافيت والخارصين |
المركم الرصاص |
|
فرق الجهد الناتج |
|
|
|
المصعد والمهبط |
|
|
|
المحلول الكهرلي |
|
|
|
قابلية إعادة الشحن |
|
|
|
عمرها النسبي |
|
|
|
أثرها البيئي |
|
|
الإجابة:
|
وجه المقارنة |
خلية الغرافيت والخارصين |
المركم الرصاص |
|
فرق الجهد الناتج |
حوالي 1,5 فولت |
حوالي 12 فولت |
|
المصعد والمهبط |
المصعد: وعاء أسطواني من فلز الخارصين المهبط: قضيب من الغرافيت (كربون) محاط بخليط من مسحوق الغرافيت وثاني أكسيد المنغنيز MnO2 |
المصعد: Pb المهبط: PbO2 |
|
المحلول الكهرلي |
عجينة من كلوريد الأمونيوم NH4Cl وكلوريد الخارصين ZnCl2 |
H2SO4 |
|
قابلية إعادة الشحن |
غير قابلة للشحن |
قابلة لإعادة الشحن |
|
عمرها النسبي |
عمرها قصير |
عمرها أطول من البطارية الجافة |
|
أثرها البيئي |
ضارة بالبيئة |
ضارة بالبيئة |
الآثار البيئية والصحية للبطاريات
تشكل البطاريات خطراً على البيئة والصحة، لما تحتويه من مواد شديدة السميّة كالزئبق والرصاص والخارصين والكادميوم والليثيوم والمنغنيز والنيكل، ومن تلك الآثار الصحية والبيئية:
- عند التخلص من البطاريات في مكبات النفايات بالحرق، فتنتج أبخرة وغازات سامة تلوث البيئة وتضر بصحة الإنسان.
- إذا سحقت البطارية فإن المواد الكيميائية تتسرب إلى المياه الجوفية.
- تسرب الماء إلى داخل البطارية يؤدي إلى تفاعله مع مكونات البطارية وإنتاج غاز الهيدروجين فيتسبب بانفجار البطارية.
طرق التخلص من البطاريات المستهلكة
- دفنها في حفر خاصة؛ إلا أن هذه الطريقة ليست آمنة بسبب تسرّب مكونات هذه البطارية إلى المياه الجوفية.
- بيع البطارية للمصنع لإعادة تدويرها.
إعداد : شبكة منهاجي التعليمية
05 / 06 / 2023
النقاشات